酸雨的pH______(>,<,=)5.6,写出形成硫酸型酸雨的相关的化学方程式:二氧化硫与雨水___________________________,再被氧化成硫酸___________________
海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):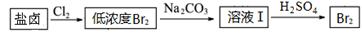
将Br2与Na2CO3反应的化学方程式补充完整:
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):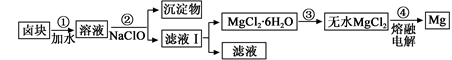
生成氢氧化物沉淀的pH
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
| Mg(OH) 2 |
9.6 |
11.1 |
①步骤②中需控制pH=9.8,其目的是。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是。
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClOg。
(本题共12分)二甲醚被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上常采用甲醇气相脱水法来获取。其反应方程式为:2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
完成下列填空:
28、有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式;
写出甲醇分子中官能团的电子式。
29、碳与同主族的短周期元素相比,非金属性较强的是(填元素符号)。写出一个能证明你的结论的化学方程式。
30、在温度和体积不变的情况下,能说明反应已达到平衡状态的是(选填编号)
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
31、一定温度下,在三个体积约为2.0 L的恒容密闭容器中发生上述反应:
| 容器 编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
||
| I |
387 |
0.40 |
0.16 |
0.16 |
| Ⅱ |
387 |
0.80 |
a |
|
| Ⅲ |
207 |
0.40 |
0.18 |
0.18 |
(1)若要提高CH3OH的平衡转化率,可以采取的措施是(选填编号)。
a.及时移走产物 b.升高温度c.充入CH3OHd.降低温度
(2)I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为(用含t的式子表示)。II号容器中a =mol。
32、若起始时向容器I中充入CH3OH 0.2mol、CH3OCH3 0.30mol和H2O 0.20mol,则反应将向(填“正”“逆”)反应方向进行。
物质的类别和核心元素的化合价是研究物质性质的两个基本视角。根据下图,完成下列填空: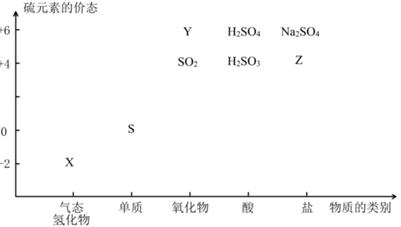
27.上图中X的电子式为;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化;该变化体现出硫元素的非金属性比氧元素(填“强”或“弱”)。用原子结构解释原因。
28.Na2S2O3是一种用途广泛的钠盐。下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______(填字母序号)。
a.Na2S+ S b.Z+ S c.Na2SO3 + Y d.NaHS + NaHSO3
29.SO2是主要大气污染物之一。工业上烟气脱硫的方法之一是用碱液吸收,其流程如图: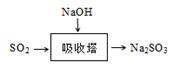 。
。
该法吸收快,效率高。若在操作中持续通入含SO2的烟气,则最终产物为________。室温下,0.1mol/L①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是________。(用编号表示)
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2SO3:Ki1=1.3×10-2 Ki2=6.2×10-8
30.治理含CO、SO2的烟道气,也可以将其在催化剂作用下转化为单质S和无毒的气体:
2CO(g) + SO2 (g) S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是(填写字母序号)。
S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是(填写字母序号)。
a.v (CO) ∶v(SO2) = 2∶1 b.平衡常数不变
c.气体密度不变d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为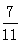 ,则SO2的转化率为。
,则SO2的转化率为。
铝是地壳中含量最高的金属元素,其单质及其化合物在生产生活中的应用十分广泛。
23.铝原子最外层电子排布式是,铝原子核外有种能量不同的电子。
24.1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝。不用钾与氯化铝溶液制铝的理由是_________;现代工业炼铝是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为。
25.用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:2Al+4BaO 3Ba↑+BaO·Al2O3,用化学平衡移动原理解释上述方法可制取金属Ba的原因是。
3Ba↑+BaO·Al2O3,用化学平衡移动原理解释上述方法可制取金属Ba的原因是。
26.LiAlH4由Li+、A1H4一构成,是有机合成中常用的试剂,LiAlH4在125℃分解为LiH、H2和Al。
(1)比较Li+、 H一、Al3+、H+离子半径大小。
(2)写出LiAlH4分解的方程式(需配平),若反应生成3.36 L氢气(标准状况下),则有g铝生成。
(3)LiAlH4与乙醛反应可生成乙醇,推断LiAlH4是反应的剂。
(17分)I.将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:
N2O4(g)  2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示: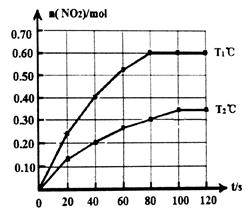
(1)Tl℃时,40s~80s内用N2O4表示该反应的平均反应速率为_________________mol/(L·s)。
(2)△H___________O(填“>”、“<”或“=”)。
(3)改变条件重新达到平衡时,要使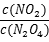 的比值变小,可采取的措施有__________(填序号)。
的比值变小,可采取的措施有__________(填序号)。
a.增大N2O4的起始浓度b.升高温度
c.向混合气体中通入NO2d.使用高效催化剂
II.已知:常温下,HCN的电离常数为Ka=5×10-10。
(4)有浓度相同的HCN和NaCN的混合溶液。
①通过计算说明该溶液的酸碱性_____________________________________________。
②该溶液中各离子的浓度由大到小的顺序是___________________________________。
(5)常温下,向某浓度的HCN溶液中逐滴加入NaOH溶液至溶液呈中性。
①该过程溶液中水的电离程度的变化为______________。
②若混合溶液中c(Na+)="a" mol/L,则c(HCN)=_________mol/L。