某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下: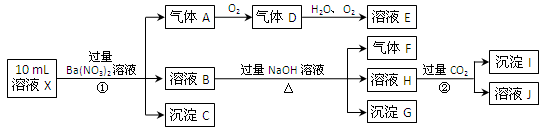
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离是 ,不能确定是否含有的离子(Q)是 ,若要确定该Q(若不止一种,可任选一种)不存在,最可靠的化学方法是 。
(2)沉淀G的化学式为 。
(3)写出有关离子方程式:①中生成A 。
② 。
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,当沉淀C物质的量(填“<”、“=”或“>”某个值) ,表明Q离子一定是 。(若不止一种可能,填对一种情况即可)
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)写出氨气的电子式。
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为。
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)===N2O4(1)△H1=-19.5kJ·mol-1
②N2H4 (1)+ O2(g)===N2(g) + 2H2O(g)△H2= -534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式。
(4)肼一空气燃料电池是一种碱性电池,工作时释放出N2,该电池放电时,负极的反应式为。
(共12分)
(1)常温常压下,烷烃同系物中一氯代物仅有一种的气态烃有若干种。其名称分别为:。
(2)某烃的分子式为C10H14,它既不能使溴水反应褪色,又不能使酸性KMnO4溶液褪色。该烃的核磁共振氢谱中仅有四组吸收峰。试写出其键线式。
(3)某药物中间体的分子式为C8H10O2,且满足以下条件
a、属于芳香烃化合物
b、核磁共振氢谱(PMR)中有3组不同的吸收峰,且面积之比为2:4:4
c、能与Na反应生成H2
① 该有机物的结构简式。
② 写出该有机物在Cu为催化剂下被氧气氧化的方程式。
(4)仅用一种试剂就可区分:甲苯、溴苯、苯乙烯、苯酚溶液四种有机物,该试剂是。
| A.FeCl3溶液 | B.KMnO4 | C.溴水 | D.水 |
(5)有机物A的结构简式如图所示,则此有机物可发生的反应类型有(填序号)。
① 取代反应②加成反应③消去反应④氧化反应⑤还原反应⑥加聚反应
磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物有着广泛的应用。
(1)2P(s)+3Cl2(g)==2PCl3(g)ΔH = -612 kJ/mol
P(s)+5/2Cl2(g)==PCl5(g)ΔH = -399 kJ/mol
写出PCl5分解成PCl3和Cl2的热化学方程式是。
(2)PCl5分解成PCl3和Cl2的反应是可逆反应。T℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过250 s达到平衡。反应过程中测定的部分数据见下表:
| t / s |
0 |
50 |
150 |
250 |
350 |
| n(PCl3) / mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
反应在50~150s 内的平均速率v(PCl3)=。
(10分) (Ⅰ)观察图A、B、C,回答下列问题:
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片______(填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为。
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)、。
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,写出正极的电极反应式。
(Ⅱ)将铜粉末用10%H2O2和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| 铜的平均溶解速率 (×10-3mol•L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是。
.W、X、Y、Z、M、G六种主族元素分属三个短周期,且原子序数依次增大。Y是地壳中含量最多的元素;M与Y同主族;G与Z形成的化合物是厨房常用的的调味品;X的简单气态氢化物水溶液呈碱性。请回答下列问题:
(1)M在元素周期表中的位置为_________,X的简单气态氢化物的电子式为_____________,W、Y、Z、M、G形成的简单离子的半径大小顺序是___________________(用相应的离子符号表示)。
(2)Y与M的氢化物中,热稳定性更好的是______(填化学式),原因是_______________
(3)由 W、Y、Z、M组成的两种盐(均含有以上四种元素)的溶液反应可产生MY2气体,写出其反应的离子方程式________________________
(4)如图,A、B两极均为惰性电极,a是Z与G形成的饱和溶液,实验开始 时,同时在两边各滴入几滴酚酞试液,则
①电解池中A极上的电极反应式为。在A极附近观察到的现象是。
②B电极上的电极反应式为,检验该电极反应产物的方法是______________________
(5)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的X4分子。X4分子结构如下图所示,已知断裂lmolX-X吸收167kJ热量,生成1mo1X2放出942kJ热量。根据以上信息和数据,下列说法正确的是____________。
A.X4沸点比P4(白磷)高,属于原子晶体
B.lmol X4气体转变为X2放出882kJ热量
C.X4与X2互为同素异形体
(6)发射“神六”时用X2W4作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知生成1mol水蒸气时放热284kJ,写出X2W4 (g)和NO2(g)反应的热化学方程式__________________,已知H2O(l)==H2O(g) ΔH =+44kJ/mol,则16g X2W4 (g)与NO2反应生成液态水时放出的热量是________kJ。
同时,X2W4可作为新型燃料电池的燃料,在氧气中燃烧生成氮气和水,请利用X2W4、氧气与KOH溶液组成碱性燃料电池,写出该电池负极的电极反应式_______________,指出电解质溶液中OH-离子向________极移动。