已知反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )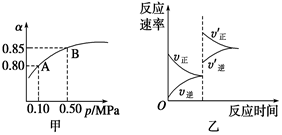
| A.由图甲知,A点SO2的平衡浓度为0.4 mol/L |
| B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2 |
| C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
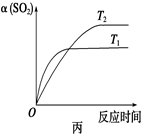
| D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3,下列各项排序正确的是:
| A.PH:②>③>④>① | B.C(CH3COO-):②>④>③>① |
| C.溶液中C(Na+):①>③>②>④ | D.C(CH3COOH):①>④>③>② |
在水电离出来的氢离子浓度为10-13mol/L的溶液中,下列各组离子一定不能大量存在的是
| A.Na+、NO3-、Al3+、K+ | B.Na+、ClO3-、ClO-、ClO4- |
| C.K+、Cr2O72-、I-、Na+ | D.Na+、S2O32-、SO42-、NH4+ |
向体积为Va的0.05mol/L CH3COOH溶液中加入体积为Vb的0.05mol/LKOH溶液,下列关系错误的是:
| A.Va>Vb时:C(CH3COOH)+ C(CH3COO-)>C(K+) |
| B.Va=Vb时:C(CH3COOH)+ C(H+)="=" C(OH-) |
| C.Va<Vb时:C(CH3COO-)>C(K+)>C(OH-)>C(H+) |
| D.Va与Vb任意比时:C(K+)+C(H+)==C(OH-)+C(CH3COO-) |
已知复分解反应:2 CH3COOH+Na2CO3==2CH3COONa+ H2O+CO2↑可自发进行。在常温下,测得浓度均为0.1mol/L的下列六种溶液的PH:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| PH值 |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
表中数据提示出复分解反应的一条规律,即碱性较强的物质发生类似反应可生成碱性较弱的物质。依据该规律,请你判断下列反应不能成立的是:
| A.CO2 +H2O+ NaClO="=" NaHCO3+HClO | B.CO2 +H2O+ 2NaClO="=" Na2CO3+2HClO |
| C.CH3COOH+ NaCN="=" CH3COONa+HCN | D.CH3COOH+ NaClO="=" CH3COONa+ HClO |
常温下,下列关于pH值的说法正确的是
| A.在pH=12的溶液中,由水提供的c(OH-)一定是10-12mol/L。 |
| B.把pH=2与pH=12的酸、碱溶液等体积混合后,所得溶液的pH值为7 |
| C.pH=6与pH=4的两盐酸等体和混合后,所得溶液中c(H+)最接近0.5×(10-8+ 10-10)mol/L |
| D.在稀氨水里加入NH4Cl晶体后,pH值会降低,若再向此溶液中加入少量稀盐酸或少量氢氧化钠溶液后,溶液的pH值都几乎不变 |