(8分)(1)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:_________________ 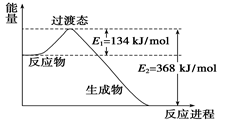
(2)我国实施“嫦娥探月”行动的长征火箭中使用偏二甲肼[(CH3)2N—NH2]作为燃料,其与过氧化氢发生反应放出大量热量C2H8N2(l)+8H2O2(l)===N2(g)+2CO2(g)+12H2O(g) ΔH=-2 500 kJ/mol。如果1 mol偏二甲肼与过氧化氢发生上述反应生成液态水,则反应中放出的热量Q______2 500 kJ(填“<”、“>”或“=”)。
(3)恒温恒容下,2 mol H2与2 mol N2反应达到平衡时,N2为1.8 mol,H2的转化率为________;若该反应在恒温恒压条件下进行(其他条件相同),反应达平衡时,H2的转化率比上述条件下H2的转化率________(填“大”、“小”或“相等”)。
实验室利用饱和NaNO2溶液(12mol/L)和NH4Cl溶液加热制备N2。
(1)若配制250 mL上述NaNO2溶液需要的玻璃仪器 ,可用 法收集N2。
(2)写出上述实验原理的离子方程式 并标出电子转移的数目和方向(单线桥法或双线桥法都可)
(3)NH4Cl溶液中加人镁粉也可以产生气体,写出相应的化学方程式
(4)向20 mL 0.01 mol/L的HNO2溶液中逐滴滴加相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液的体积的变化如图所示:(已知HNO2的电离平衡常数为K=4.6X10-4)则图中a点的c(H+)= ,b点溶液呈酸性的原因是(结合离子方程式表示) (已知 )。
)。
已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,G的+1价阳离子正好充满K,L,M三个电子层。回答下列问题:
(1)A、B、C、D、E、F、G几种元素中第一电离能最小的是____(填元素符号),D元素的原子核外有 种不同运动状态的电子;有 种不同能级的电子。基态的F3+核外电子排布式是 。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是 。
(3)化合物ECAB中的阴离子与AC2互为等电子体,该阴离子的电子式是 。
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是 。
(5)化合物EF[F(AB)6]是一种蓝色晶体,下图表示其晶胞的

(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为 。
(6)G的二价阳离子能与乙二胺(H2N—CH2一CH2一NH2)形成配离子:该配离子中含有的化学键类型有 。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
阴离子CAB-中的A原子与乙二胺(H2N—CH2一CH2一NH2)中C原子的杂化方式为 。
(共12分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO(s)+Cr2O3(s)+8Na2CO3(s)+7O2(g) 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)请写出上述反应的化学平衡常数表达式:K=__________________。
(2)图1、图2表示上述反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。
由图1判断,反应进行至t2时,曲线发生变化的原因是________________(用文字表达);
由图2判断,t2到t3的曲线变化的原因可能是________(填写序号)。
a.升高温度b.加了催化剂 c.通入O2 d.缩小容器体积
(3)工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
①已知该反应能自发进行,则下列图像正确的是________________
②在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考查温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);下列说法正确的是______(填序号)
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率:v(CH3OH)= mol·L-1·min-1 mol·L-1·min-1 |
| B.该反应在T1时的平衡常数比T2时的小 |
| C.该反应为放热反应 |
D.处于A点的反应体系从T1变到T2,达到平衡时 增大 增大 |
③在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,CO2转化率为a,则容器内的压强与起始压强之比为___________。
(共6分)下图是可逆反应A+2B  2C+3D的化学反应速率和化学平衡随外界条件改变而变化的情况。由图可推断:
2C+3D的化学反应速率和化学平衡随外界条件改变而变化的情况。由图可推断:
(1)正反应是 反应,(填放热或吸热)
(2)若A、B是气体,则C的状态是 ,D的状态是 。
现有7瓶失去标签的液体,已知它们是有机试剂,可能是:①乙醇、②乙酸、③苯、④乙酸乙酯、⑤油脂、⑥葡萄糖溶液、⑦蔗糖溶液。现通过如下实验步骤来确定各试剂瓶中所装的液体:
| 实验步骤和方法 |
实验现象 |
| ①把7瓶液体分别依次标号A、B、C、D、E、F、G后,闻气味 |
只有F、G两种液体没有气味 |
| ②各取少量于试管中加水稀释 |
只有C、E、D三种液体不溶解而浮在水面上 |
| ③分别取少量7种液体于试管中加新 制Cu(OH)2悬浊液并加热 |
只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取少量C、E、D于试管中,加稀NAOH 溶液并加热 |
只有C仍有分层现象,且在D的试管中闻 到特殊香味 |
(1)试给它们的试剂瓶重新贴上标签,其中:
A____________, C____________, E________,F___________,G________。
(2)写出D与NAOH溶液的化学反应方程式:_____________。