已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,G的+1价阳离子正好充满K,L,M三个电子层。回答下列问题:
(1)A、B、C、D、E、F、G几种元素中第一电离能最小的是____(填元素符号),D元素的原子核外有 种不同运动状态的电子;有 种不同能级的电子。基态的F3+核外电子排布式是 。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是 。
(3)化合物ECAB中的阴离子与AC2互为等电子体,该阴离子的电子式是 。
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是 。
(5)化合物EF[F(AB)6]是一种蓝色晶体,下图表示其晶胞的

(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为 。
(6)G的二价阳离子能与乙二胺(H2N—CH2一CH2一NH2)形成配离子:该配离子中含有的化学键类型有 。(填字母)

a.配位键 b.极性键 c.离子键 d.非极性键
阴离子CAB-中的A原子与乙二胺(H2N—CH2一CH2一NH2)中C原子的杂化方式为 。
氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。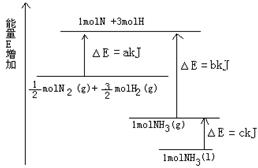
(1)上图是N2与H2反应过程中能量变化的示意图,则该反应生成液态氨的热化学方程式是______________________。
(2).若由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436. 0kJ/mol,则N-H键的键能是________ kJ/mol。
分子式为C2H6O的化合物A具有如下性质:
(1)根据上述信息,对该化合物可作出的判断是。
| A.一定含有—OH | B.一定含有—COOH | C.A为乙醇 | D.A为乙酸(2)含A的体积分数为75%的水溶液可以用作。 |
(3)A与钠反应的化学方程式:。
(4)A可由含淀粉[(C6H10O5)n]的农产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出由淀粉制A的化学方程式:。
A、B、C、D四种元素,A元素所处的周期数,主族序数,原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C
(1)B元素的名称,________B在周期表中的位置_________________________,
(2)A、B形成的化合物的电子式________;
(3)C的元素符号________,C的最高价氧化物的化学式________;
(4) D的最高价氧化物的水化物中含有____________键。
(5) 用电子式表示D2C的形成过程:________________________________。
下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D为常见金属单质,B、C为金属氧化物,H为白色沉淀,I为红褐色沉淀。(反应过程中生成的水及其他产物已略去)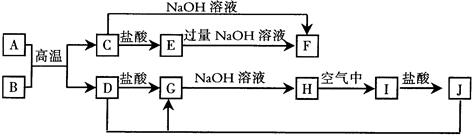
请回答以下问题:
(1)A在元素周期表中的位置是;写出A单质与NaOH溶液反应的化学方程式
(2)写出反应“J+D→G”的离子方程式:;实验室也可以将G直接转化为J,所用的试剂为。
(3)C与NaOH溶液反应、E与过量的NaOH溶液反应,其产物之一都含A元素,该产物中A元素的存在形式为(用化学符号表示)。
有X、Y、Z三种主族元素形成的3种离子X(n+1)+,Y m-,Z m+,已知m > n,X(n+1)+比Z m+多一个电子层,Z与Y同周期,则进行下列推断:
(1)X、Y、Z三种原子的原子半径由大到小的顺序是>>。
(2)X(n+1)+、Y m-、Z m+三种离子的半径由大到小的顺序是>>。
(3)三种元素最高价氧化物对应水化物碱性依次减弱,酸性依次增强的顺序是