(选修5-有机化学基础)两种有机物A、B的分子式均为C11H12O5,均能发生如下变化。
已知:①A、B、C、D均能与NaHCO3反应;
②只有A、D能与FeCl3溶液发生显色反应,且苯环上的一溴代物只有两种;
③F能使溴水褪色且不含有甲基;
④H能发生银镜反应
请根据题意回答下列问题:
(1)写出F的结构简式________;D的含氧官能团有(写名称)________。
(2)反应③的反应类型是_________;反应⑥的条件是__________。
(3)写出反应②的化学方程式__________________________。
(4)写出B与足量NaOH溶液反应的化学方程式:________________。
(5)下列关于A~I的说法中错误的是 (选填编号)。
a.A与B、E与I均互为同分异构体
b.D在一定条件下也可以反应形成高聚物
c.G具有8元环状结构
d.等质量的A与B分别与足量NaOH溶液反应,消耗等量的NaOH
(6)D的同分异构体有很多,同时符合下列要求的同分异构体有 种。
①苯环上的一卤代物有2种 ②与FeCl3溶液发生显色反应 ③发生银镜反应
芳炔类大环化合物的研究发展十分迅速,具有不同分子结构和几何形状的这一类物质在高科技领域有着十分广泛的应用前景。合成芳炔类大环的一种方法是以苯乙炔
(CH≡C- )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
(1)上述系列中第1种物质的分子式为。
(2)已知上述系列第1至第4种物质的分子直径在1~100nm之间,分别将它们溶解于有机溶刑中,形成的分散系为。
(3)以苯乙炔为基本原料,经过一定反应而得到最终产物。假设反应过程中原料无损失,理论上消耗苯乙炔与所得芳炔类大环化合物的质量比为。
(4)在实验中,制备上述系列化合物的原料苯乙炔可用苯乙烯(CH2=CH- )为起始物质,通过加成、消去反应制得。写出由苯乙烯制取苯乙炔的化学方程式(所需的
)为起始物质,通过加成、消去反应制得。写出由苯乙烯制取苯乙炔的化学方程式(所需的 无机试剂自选)
无机试剂自选)
在一定温度下将2 mol A和2 mol B两种气体混合于某2L密闭容器中,发生如下反应:3A(g)+B(g)  2C(g)+2D(g),2 min末反应达到
2C(g)+2D(g),2 min末反应达到 平衡状态,生成了0.8 mol D,请填写下列空白:
平衡状态,生成了0.8 mol D,请填写下列空白:
(1)2min内B的反应速率为_________________
(2)此温度下该反应的平衡常数K=_________________________
(3)如果缩小反应容器的体积,使压强增大,平衡体系中C的物质的量浓度_____________,C的质量分数___________,容器内气体的平均密度________________,平均相对分子质量________________。(填“增大”、“减小”或“不变”)
(4)如果上述反应在相同条件下从逆反应开始进行,开始加C和D各4/3 mol,要使平衡时各物质的物质的量与原平衡相等,则还应加入__________物质___________mol。
在一定条件下,CH4和CH3OH的燃烧的热化学方程式分别为:
CH4(g)+2O2(g)=CO2(g) + 2H2O(g) ΔH=-890kJ/mol
CH3OH(g)+1.5O2(g)=CO2(g) + 2H2O(g) ΔH=-750kJ/mol
如果有CH4和CH3OH的混合气体充分燃烧,放出的热量为806kJ,将生成的气体通过浓硫酸,浓硫酸增重36g。则混合气体中CH4和CH3OH的体积比________。
自 然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内
然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内 SiO2和HF存在以下平衡:SiO2 (s) + 4HF(g)
SiO2和HF存在以下平衡:SiO2 (s) + 4HF(g)  SiF
SiF 4 (g) + 2H2O(g)
4 (g) + 2H2O(g)
△H=-148.9 kJ/mol,根据题意完成下列填空:
(1)在地壳深处容易有__________气体逸出,在地壳浅处容易有________沉积
(2)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,____________(选填编号)。
a.2v正(HF)=v逆(H2O) b.混合气体的密度保持不变
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(3)如果上 述反应的平衡常数K值变大,该反应_________(选填编号)。
述反应的平衡常数K值变大,该反应_________(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆 反应速率先减小后增大
反应速率先减小后增大
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为__________________________。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为________________________;
(3)在容积为2 L的密闭容器中,由CO2和H2合成甲醇(CO2+3H2  CH3OH + H2O)
CH3OH + H2O)
在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);下列说法正确的是______(填序号)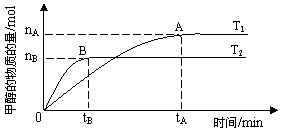
①温度为T1时,从反应开始到平衡,
生成甲醇的平均速率为v(C H3OH) =nA/tA mol·L-1·min-1
H3OH) =nA/tA mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)/n(CH3OH )增大
)增大
(4)在T1温度 时,将1mol CO2和3mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______________________
时,将1mol CO2和3mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______________________ ___。
___。