(14分)有关元素A、B、C、D的信息如下:
| 元 素 |
有关信息 |
| A |
最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B |
地壳中含量最高的元素,A与B可形成一种质量比为 7:12的化合物(丙) |
| C |
单质曾用于焊接钢轨 |
| D |
单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
请回答下列问题:
(1)用C单质来焊接钢轨的化学方程式是 。
(2)有关C与D元素,下列说法正确的是 (填序号)。
A.C或D的高价盐均可用做净水剂
B.用C或D单质做成的槽车,都可用来运输甲的稀溶液
C.C、D的单质与稀硫酸组成的原电池,C电极发生氧化反应
D.C的合金可用来做车船材料和门窗等
(3)B的一种氢化物在碱性溶液中可与丙反应,生成物中A元素只显其最高价态,该反应的离子方程式是 。
(4)已知:2AB2(g) A2B4(g) △H<O。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通人容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
A2B4(g) △H<O。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通人容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
①a、b、c、d四个点中,化学反应处于平衡状态的是 点。
②25min时,增加了 (填物质的化学式) mol。
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是 (填字母)。
现有Na2CO3和NaHCO3的混合物共13.7g,现把混合物充分加热到不再有气体放出为止,发现混合物质量变为10.6g,试计算原混合物中Na2CO3的物质的量。
用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:
(1)计算机芯片的主要成分是(填化学式,以下同);
(2)光导纤维的主要成分是:
(3)目前应用最多的太阳能电池的光电转化材料是;水玻璃的成分是。
在铝质易拉罐中收集满CO2气体,然后在其中倒入过量浓NaOH溶液,并迅速用胶带将易拉罐口封住,能够观察到的实验现象是易拉罐突然变瘪了,可经过一段时间之后,又可以观察到的现象是。试解释易拉罐变瘪的原因;并解释后一现象的原因。写出反应过程中的两个离子方程式;。
(1)在氧化还原反应中,氧化剂______电子,发生的反应是_________反应;还原剂________电子,发生的反应是____________反应。铁与氯气反应的方程式为_________,生成物中铁是_______价,铁与盐酸的反应式为________,生成物中铁是________价,这一事实证明,氯气的氧化性比盐酸的氧化性(填“强”“弱”)____________。
(2)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。其中被还原的元素是(填元素符号),被氧化的元素是(填元素符号),氧化剂是(填化学式,以下同),还原剂是,氧化产物是,还原产物是。
2010年美、日三位科学家因钯(Pd)催化的交叉偶联反应获诺贝尔化学奖。一种钯催化的交叉偶联反应如下: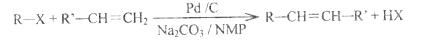
(R、R’为烃基或其他基团)
应用上述反应原理合成防晒霜主要成分K的路线如下图所示(部分反应试剂和条件未注明):
已知:①B能发生银镜反应,1 mol B最多与2 mol H2反应。
②C8H17OH分子中只有一个支链,且为乙基,其连续氧化的产物能与NaHCO3反应生成CO2,其消去产物的分子中只有一个碳原子上没有氢。
③G不能与NaOH溶液反应。
④核磁共振图谱显示J分子有3种不同的氢原子。
请回答:
(1)B中含有的官能团的名称______________。
(2)B→D的反应类型__________________。
(3)D→E的化学方程式_____________。
(4)有机物的结构简式:G________________;K______________。
(5)符合下列条件的同分异构体有(包括顺反异构)______________种,其中一种的结构简式是_______________。
a. 与D互为同系物 b. 相对分子质量是86
(6)分离提纯中间产物E的操作:先用碱除去D和H2SO4,再用水洗涤,弃去水层,最终通过___________操作除去C8H17OH,精制得E。