纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。巳知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:
(1)某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了_______。
(2)ACl2分子中A的杂化类型为_______。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C—C的键长为154.45pm,C60中C—C键长为145〜140pm,有同学据此认为C60的熔点高于金刚石,你认为此说法是否正确_______ (填“正确”或“不正确”),并阐述理由。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式 ,该物质中K原子和C60分子的个数比为_______。
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是_______,NCl3分子的价层电子对互斥理论模型为_______。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足 8电子稳定结构,则分子中π键的数目为_______
X、Y、Z、W、V是原子序数依次增大的短周期主族元素,其中两种为金属元素。Y的原子半径是短周期主族元素中最大的,Z的单质可与Y的最高价氧化物的水化物溶液反应,X与W同主族,且W的原子序数是X的两倍。请回答下列问题:
(1)W的氢化物的电子式是,其相对分子质量与H2O2的相对分子质量相等,但其沸点却低于H2O2的沸点,可能的原因是_________________________;
(2)Z的单质与Y的最高价氧化物的水化物溶液溶液反应的离子方程式是______________;
(3)X与W以原子个数比2∶1形成的化合物能使溴的水溶液褪色,写出反应的离子方程式__________,该化合物表现了性;
(4)V的单质溶于水后形成的溶液中存在的粒子有种。
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。全钒液流电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子【V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO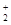 (黄色)】为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O
(黄色)】为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O V2++VO
V2++VO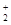 +2H+。如图1是钒电池基本工作原理示意图:
+2H+。如图1是钒电池基本工作原理示意图: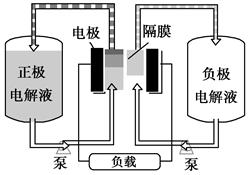
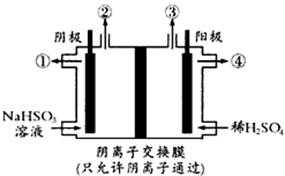
图 1图 2
请回答下列问题:
(1)放电时的正极反应式为_________________________;
(2)充电时的阴极反应式为________________,充电过程中,电解液的pH(选填“升高”“降低”或“不变”)。
(3) 放电过程中氢离子的作用是____________________________;若充电时转移电子的数目为6.02×1023,则左槽溶液中H+的变化量为mol 。
(4) 以全钒液流电池为电源,用惰性电极电解NaHSO3溶液可制得硫酸,装置如图2所示。阴极的电极反应式为。
(5)电解过程中③处的生成物是(填化学式)。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: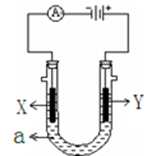
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①在X极附近观察到的实验现象是。
②电解NaCl溶液的离子方程式是。
③将Y电极反应产物通入Na2S溶液中,发生反应的离子方程式为。
(2)若要在铁制品上镀一定厚度的Ag,Y电极反应式为,工作一段时间后pH将___________(填“增大”或 “减小”或“不变”) 。
(3)若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2g,该金属的摩尔质量是______________。
砷(As)广泛分布于自然界,其原子结构示意图是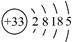 。
。
(1)砷位于元素周期表中族,其气态氢化物的稳定性比NH3 (填“强”或“弱”)。
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据下图写出As2O5分解为As2O3的热化学方程式:。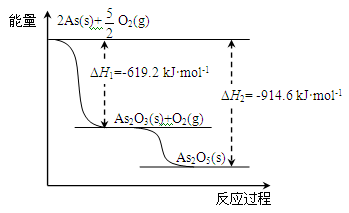
(3)砷酸盐可发生如下反应:AsO43-+2I﹣+2H+ AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。
AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。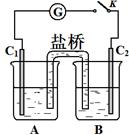
①A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3
的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针
向右偏转。此时C2上发生的电极反应是。
② 一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH
溶液,可观察到电流计指针(填“不动”、“向左偏”或“向右偏”)。
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
① 将试样溶于NaOH溶液,得到含AsO43-和AsO33-的混合溶液。As2O5与NaOH溶液反应的离子方程式是。
② 上述混合液用0.02500 mol·L-1的I2溶液滴定,消耗I2溶液20.00 mL。滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000 mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00 mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是g。
(本题包括2部分,共14分)
Ⅰ.X、Y、Z、W均为短周期元素组成的单质或化合物。在一定条件下有如下转化关系: X+Y→Z+W
(1)若构成X的阴、阳离子个数比为1︰2,且构成X的阴、阳离子中分别含有18个和10个电子,构成Z的阴、阳离子中均含有10个电子。则Z的电子式为。
(2)若X、Y、Z、W四种物质均为分子,且X分子中含18个电子,Y、Z分子中均含有10个电子,单质W分子中含有16个电子。则此化学反应的类型为。
(3)若X、W均为单质,Y、Z均为氧化物且Y、Z中氧的质量分数分别为50%和40%。则该反应的化学方程式为。
(4)若X、Y、Z、W均为非金属氧化物,X的式量比Z的式量小16,Y的式量比W的式量大16,Y是光化学烟雾的主要“元凶”,则该反应的化学方程式为。
Ⅱ.近年来,某些轻元素的含氢化合物及其复合体系作为氢源受到广泛关注。化合物A(XYH2)和B(XH)都是具有潜在应用价值的释氢材料。A受热分解生成固体化合物C并放出刺激性气体D,D可使湿润的pH试纸变蓝;B中X元素的质量分数为87.5%。A和B混合可优化放氢性能。研究发现,该混合体系的放氢反应分三步进行:(1)2A =" C" + D(2)D + B =" A" + H2(3)C + B =" E" + H2
(5)X元素的名称为。
(6)写出A和B混合放氢的化学反应方程式:。
(7)A、C、E均能水解且生成同样的产物,请写出物质C与水反应的化学方程式:。