欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暧,研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
___C+___K2Cr2O7+___—___CO2↑+ ___K2SO4+ ___Cr2(SO4)3+___H2O
①完成并配平上述化学方程式。
②在上述方程式上标出该反应电子转移的方向与数目。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式________
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图1,该电池反应的离子方程式为_____________________。
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①该反应的平衡常数表达式为K_______。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数 (CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0 (填“>”、“<”或“ =” )。
(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0 (填“>”、“<”或“ =” )。
③在同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线 I、II对应的平衡常数大小关系为KI_______KII(填“>”、“<”或“ = ”)。
有浓度均为0.1 mol·L-1的盐酸、硫酸和醋酸三种溶液,试分析:
(1)若溶液的C(H+)分别为a、b、c,则它们的大小关系是 (用“>”“<”“=”表示),
(2)分别用三种酸中和等物质的量的氢氧化钠溶液,所需溶液的体积分别是a、b、c, 则它们的大小关系是 (用“>”“<”“=”表示)。
(3)等体积的三种酸分别与足量的锌粒反应,在相同条件下若产生气体的体积分别为a、b、c,则它们的关系是 。
(4)可逆反应2Cl2(g)+2H2O(g) 4HCl(g)+O2(g) △H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g) △H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
①降低温度,Cl2的转化率__________; ②保持容器体积不变,加入He,则HCl的物质的量__________;③保持容器压强不变,加入He,则O2的体积分数__________。
(1)在25℃、101kPa下,1g CH4(g)完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出该反应的热化学方程式:_ _
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。其热化学方程式为__
(3)已知拆开1mol H—H键、1mol N—H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为______________________
(4)已知热化学方程式:
① C2H2(g) +5/2O2(g) ="=" 2CO2(g)+H2O(l)ΔH1=-1301.0 kJ•mol-1
② C(s)+ O2(g) ="=" CO2(g)△H2=-393.5 kJ•mol-1
③ H2(g)+  O2(g) ="=" H2O(1)△H3 =" -285.8" kJ·mol-1
O2(g) ="=" H2O(1)△H3 =" -285.8" kJ·mol-1
则反应④ 2C(s)+ H2(g) ="=" C2H2(g)的△H为
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是________________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为________________
(3)根据上述反应可推知________________ (填序号)。
a.氧化性:H3AsO4>HBrO3 b.氧化性:KBrO3>H3AsO4
c.还原性:AsH3>X d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。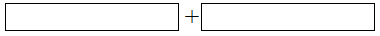
选择下列实验方法分离物质,将分离方法的字母填在横线上
A萃取分液法 B加热分解法 C重结晶法
D分液法 E蒸馏法 F过滤法
(1)________分离饱和食盐水和沙子的混合物
(2)________从硝酸钾和氯化钠的混合溶液中获得硝酸钾
(3)________分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物
(4)________分离水和植物油的混合物
在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:
CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数K2=_____,反应
CO2(g)+H2(g)的平衡常数K2=_____,反应 CO2(g)+
CO2(g)+ H2(g)
H2(g)
 CO(g)+
CO(g)+ H2O(g)的平衡常数K3=________。
H2O(g)的平衡常数K3=________。
(3)已知在1 000 ℃时,该反应的平衡常数K4为1.0,则该反应为________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是________。
| A.容器中压强不变 |
| B.c(CO2)=c(CO) |
| C.生成a mol CO2的同时消耗a mol H2 |
| D.混合气体的平均相对分子质量不变 |
(5)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v(正)________v(逆)(填“>”、“=”或“<”)。该温度下反应达到平衡时,CO2的转化率为________。