已知KNO3晶体溶解于水时要吸收热量,从溶液中析出KNO3晶体时会放出热量。若有室温下KNO3饱和溶液20 mL,向其中加入1 g KNO3晶体,充分搅拌后,下列判断正确的是( )
| A.溶液质量增加 | B.溶液的温度降低 |
| C.晶体不再溶解 | D.溶液的温度和质量都不变 |
已知铍(Be)的原子序数为4,下列对铍及其化合物的叙述中,正确的是
| A.铍的原子半径小于硼的原子半径 | B.氯化铍分子中铍原子的最外层电子数是8 |
| C.氢氧化铍的碱性比氢氧化钙弱 | D.单质铍易跟冷水反应产生氢气 |
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
| A.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2 |
| B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性 |
| C.若X(OH)n为强碱,则Y(OH)n也一定为强碱 |
| D.若Y的最高正价为+ m,则X的最高正价一定为+ m |
一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质:①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥无水乙酸 ⑦硝酸 ⑧CuCl2时,能够加快反应速率,又不影响产生H2总量的是
| A.①③④ | B.①③⑤ | C.②④⑧ | D.③⑤⑦ |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2
+ 4OH-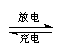 2CO32-+ 6H2O,则下列说法错误的是
2CO32-+ 6H2O,则下列说法错误的是
| A.充电时每生成1 mol CH3OH转移6 mol电子 |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32-+ 6H2O |
| D.放电时CH3OH参与反应的电极为正极 |
对于以下反应:A(s)+3B(g) 2C(g)+D(g),在一定温度和容积固定的容器中,下列判断正确的是()
2C(g)+D(g),在一定温度和容积固定的容器中,下列判断正确的是()
| A.当容器内的压强不再变化,可以判断反应已经达到平衡 |
| B.往容器中通入稀有气体He,由于压强增大,所以反应速率增大 |
| C.往容器中加入少量A,反应速率增大 |
| D.若反应是放热反应,升高温度,正反应速率增大 |