30℃时,在0.1mol/L的Na2S、NaHS两溶液中均存在的关系是( )。
| A.c(H+)·c(OH-)<1×10-14 | B.c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| C.c(OH-)=c(H+)+c(HS-)+2c(H2S) | D.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
下列化学反应的离子方程式正确的是
A.少量SO2通入Ca(Cl O)2溶液中:SO2+H2O+Ca2++2ClO- O)2溶液中:SO2+H2O+Ca2++2ClO- =CaSO3↓+2HClO =CaSO3↓+2HClO |
B.在稀氨水中通入少量CO2: 2NH3·H2O+CO2=2NH +CO32- +H2O +CO32- +H2O |
| C.用稀HCl溶液溶解FeS固体:FeS+2H+=Fe2++H2S↑ |
| D.Cl2与水反应:Cl2+ H2O =" HCl" + HClO |
某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是
A.Cl-、Mg2+、H+、SO |
B.Na+、Ba2+、OH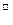 、SO 、SO |
C.K+、NO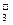 、OH-、Na+ 、OH-、Na+ |
D.MnO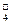 、K+、Cl-、H+ 、K+、Cl-、H+ |
A、B、C、D、E是同一周期的五种主族元素。A和B的最高价氧化物对应的水化物均呈碱性,且碱性A>B;C和D的最高价氧化物的水化物均呈酸性,且酸性C>D;E是这五种元素中原子半径最小的元素。它们的原子序数由大到小的顺序是
A.ABCDE B.CDABE C.BADCE D.ECDBA
A、B、C三种短周期元素,A与C同主族且处于相邻周期,A与B的核电荷数之差为5,B原子M层比L层电子少2个,则A、B、C三种元素分别是
A.Li、Na、S B.Na、S、Li C.Na、K、Br D.K、Br、Na
将一张浸湿了溴水的滤纸挂在SO2气体中,滤纸会由黄色变成白色,这主要是因为
| A.SO2漂白了滤纸 | B.SO2与Br2化合生成了无色的物质 |
| C.反应放热使溴挥发了 | D.Br2被SO2还原成无色的Br- |