高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
下列叙述错误的是:
| A.放电时正极附近溶液的碱性增强 |
| B.放电时每转移3 mol电子,正极有1mol K2FeO4被还原 |
| C.充电时锌极与外电源负极相连 |
| D.充电时阳极反应为:Fe(OH)3- 3e- + H2O |
下列叙述中,正确的是( )
| A.在基态多电子的原子中,可以有两个运动状态完全相同的电子 |
| B.在基态多电子的原子中,不可能有两个能量完全相同的电子 |
| C.在基态多电子的原子中,M层的电子能量肯定比L层上的电子能量高 |
| D.如果某一基态原子3p能级上仅有2个电子,它们自旋方向必然相反 |
NA为阿伏伽德罗常数,下列叙述错误的是()
| A.18gH2O中含有的质子数为10NA |
| B.12g金刚石中含有的共价键数为4 NA |
| C.46gNO2和N2O4混合气体中含有的原子总数为3 NA |
| D.1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
以乙醇为原料,用下述6种类型的反应①氧化 ②消去 ③加成 ④酯化 ⑤水解 ⑥加聚,来合成乙二酸乙二酯(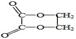 )的正确顺序是( )
)的正确顺序是( )
| A.①⑤②③④ | B.①②③④⑤ |
| C.②③⑤①④ | D.②③⑤①⑥ |
下列有机物中既能发生加成反应,又能发生酯化反应,还能被新制Cu(OH)2悬浊液氧化的物质是( )
| A.CH2=CH-CHO | B.CH3CH2COOH |
| C.CH2=CH-COOCH3 | D.CH2OH(CHOH)4CHO |
已知酸性: >H2CO3>
>H2CO3> ,综合考虑反应物的转化率和原料成本等因素,将
,综合考虑反应物的转化率和原料成本等因素,将 转变为
转变为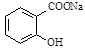 的最佳方法是( )
的最佳方法是( )
| A.与稀H2SO4共热后,加入足量NaOH溶液 |
| B.与稀H2SO4共热后,加入足量NaHCO3溶液 |
| C.与足量的NaOH溶液共热后,再通入足量CO2 |
| D.与足量的NaOH溶液共热后,再加入适量H2SO4 |