某一反应物的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的反应速率为 ( )
| A.0.04 | B.0.04mol / (L.s) | C.0.08mol(L.s) | D.0.04mol / L |
一种碳纳米管能够吸附氢气,可做充电电池(如右图所示)的碳电极,该电池的电解质为6 mol/L KOH溶液,下列说法中正确的是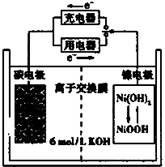
| A.充电时将碳电极与电源的正极相连 |
| B.充电时阴极发生氧化反应 |
| C.放电时镍电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- |
| D.放电时碳电极反应为:2H++2e—=H2 ↑ |
下列图像及对应说法正确的是()
A.图1表示恒温恒压下条件,向2HI  H2 + I2 ΔH>0的反应达到平衡的容器中充入HI,甲表示正反应速率,乙表示逆反应速率 H2 + I2 ΔH>0的反应达到平衡的容器中充入HI,甲表示正反应速率,乙表示逆反应速率 |
B.图1表示恒容下条件,向2HI  H2 + I2 ΔH>0的 反应达到平衡的容器加热,甲表示正反应速率,乙表示逆反应速率 H2 + I2 ΔH>0的 反应达到平衡的容器加热,甲表示正反应速率,乙表示逆反应速率 |
C.图2表示恒温条件下,压缩2SO3(g) 2SO2(g)+O2(g) ΔH>0平衡反应体系,甲表示的SO3物质的量的变化,乙表示的SO3物质的量浓度的变化 2SO2(g)+O2(g) ΔH>0平衡反应体系,甲表示的SO3物质的量的变化,乙表示的SO3物质的量浓度的变化 |
D.图2表示恒容条件下,对于2SO3(g) 2SO2(g)+O2(g) ΔH>0反应平衡体系,甲表示升高温度SO3物质的量的变化,乙表示增加O2后SO3物质的量变化 2SO2(g)+O2(g) ΔH>0反应平衡体系,甲表示升高温度SO3物质的量的变化,乙表示增加O2后SO3物质的量变化 |
下列实验操作与对应的反应现象或原理正确的一组是()
| 选项 |
实验操作 |
现象或原理 |
| A |
取少量KI溶液,先滴加氯水,再加入少量苯,振荡、静置 |
溶液分层,下层呈紫红色 |
| B |
将稀盐酸或氢氧化钠溶液慢慢滴入氢氧化铝胶体中 |
均先沉淀后溶解 |
| C |
将浓硝酸加入盛有铂、金的烧杯中,不反应,加入一定量浓盐酸后,铂、金溶解 |
浓盐酸氧化性强于浓硝酸 |
| D |
将40.0 g NaOH固体溶于1.0 L蒸馏水中配成溶液 |
溶液物质的量浓度为1.0mol﹒L-1 |
在给定的四种溶液中,含有以下各种微粒,一定能大量共存的是 ( )
| A.由水电离的c(OH-)=1×10-12mol/L的溶液中:Ba2+、K+、Br-、SiO32- |
| B.常温下葡萄糖溶液中:SCN—、Cl-、K+、NH4+ |
| C.溴水中:Na+、CO32-、NH4+、SO42— |
| D.PH大于7的溶液: Na+、Ba2+、SO32-、ClO— |
近年来,科学家合成了一种稳定的氢铝化合物Al2H6。Al2H6的球棍模型如下图所示,它的熔点为150℃,可用作高能燃料或储氢材料。下列说法正确的是 ( )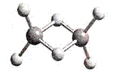
| A.Al2H6可以燃烧,产物为氧化铝和水 |
| B.1mol Al2H6中约含有4.8×1024个σ键 |
| C.60g Al2H6中含铝原子约为1.2×1023个 |
| D.Al2H6在固态时所形成的晶体是离子晶体 |