在 K2Cr2O7 + HCl —— KCl + CrCl3 + Cl2↑+ H2O反应中。
(1)氧化剂是 , 元素被氧化,氧化产物是 。
(2)在参加反应的盐 酸中,被氧化的HCl与未被氧化的HCl的质量比为 .
酸中,被氧化的HCl与未被氧化的HCl的质量比为 .
(3)如果反应生成0.1molCl2,则转移电子的数目为:
完成下反应的化学方程式或离子方程式(8分)
(1)铝与 氧化铁在高温下反应(铝热反应)
氧化铁在高温下反应(铝热反应)
______________________________________;
(2)医学上,用(胃舒平)氢氧化铝治疗胃酸过多,写出反应的离子方程式
____________________________________________________________
(3)工业上用焦炭和二氧化硅反应制得粗硅(Si)
____________________________________________________________
(4)装氢氧化钠溶液的试剂瓶不用玻璃塞,原因用化学方程式表示为_________________________________________________________
下表是元素周期表的一部分,回答下列有关问题:(8分)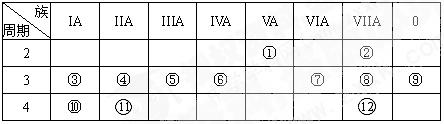
(1)写出下列元素符号:① ________⑥ ________⑦ ________。
(2)画出⑧的原子的结构示意图:_____________
(3)③、④、⑤的原子半径由大到小顺序排列为____________(用元素符号表示)
(4)最不活泼的元素是_______(填元素名称),呈两性的氢氧化物是________。(填化学式)
(5)⑩在元素周期表中的位置为_____________________
已知A为芳香烃,分子结构中只含有一个带甲基的侧链。5.9 gA完全燃烧,生成19.8 g CO2。W为B的同分异构体,其结构简式为

(1)A的分子式为,H的结构简式为;
(2)C的官能团名称为;
(3)发生取代反应的有(填反应序号);
(4)⑤的化学方程式为;
(5)符合下列3个条件的G的同分异构体的数目有个,写出其中任意一个同分异构体的结构简式。
①含有邻二取代苯环结构;②与G有相同官能团;③不与FeC13溶液发生显色反应。
a、b、c、d、e为短周期主族元素。其中
①a和b属同周期元素,二者能形成多种气态化合物;
②a和c属同周期元素,二者能形成两种气态化合物;
③a和d属同主族元素,二者能形成两种常见化合物;
④e可分别和a、b、c、d形成具有相同电子数的共价化合物甲、乙、丙、丁。
请回答:
(1)a元素为____,甲的分子式为,丁的电子式为。
(2)由上述一种或几种元素形成的物质可与水发生氧化还原反应,写出一个符合要求的化学反应方程式:。
(3)a单质和丙可形成燃料电池(以KOH溶液为电解质)。该燃料电池的负极反应式为
。
(4)乙是一种液态火箭燃料,在O2中燃烧,产物无污染。常温下,6.4 g乙燃烧放出QkJ热量,该反应的热化学方程式为____。
现有A、B、C、D、E、F六种常见化合物 ,均为强电解质,它们的阳离子有Al3+、NH+4、Na+、Ag+、H+五种,阴离子有Cl-、HCO-3、OH-、NO-3、SO2-4五种,现将它们分别配成0.lmol/L。的溶液,进行如下实验:
,均为强电解质,它们的阳离子有Al3+、NH+4、Na+、Ag+、H+五种,阴离子有Cl-、HCO-3、OH-、NO-3、SO2-4五种,现将它们分别配成0.lmol/L。的溶液,进行如下实验:
①测得A溶液呈碱性,E溶液的pH为1,C溶液的酸性强于E溶液。
②向B溶液中滴入D溶液,出现白色沉淀和无色无味气体,该白色沉淀既能溶于A溶液,又能溶于C溶液;过滤,向滤液中加入A溶液,加热,有刺激性气味气体产生。
③向B溶液中滴加F溶液,产生白色沉淀,加入过量E溶液,沉淀不溶解。
④向E溶液中滴加F溶液,无明显变化。
根据上述实验现象,回答下列问题:
(1)写出下列四种化合物的化学式:
A、B、D、F。
(2)C溶液是,判断依据是____
(3)B、D反应的离子方程式是____;