丁基橡胶可用于制造汽车内胎,合成丁基橡胶的一种单体A的分子式为C4H8,A能进行如下的转化: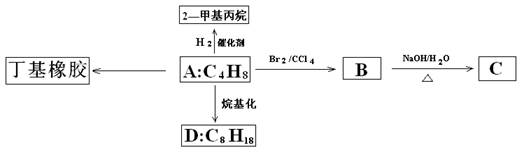
完 成下列填空:
成下列填空:
(1)A聚合成丁基橡胶的反应方程式。
;
(2)写出B到C转化的化学方程式 ;
(3)若D的H核磁共振图谱中只有一种特征峰,则D的结构简式是 ,若D的一卤代物只有4种,且碳链不对称。写出D的结构简式。 。
有下列电解装置:①用铂电极电解AgNO3溶液②用锌电极电解ZnCl2溶液③用石墨电极电解NaOH溶液④用铂电极电解NaCl溶液⑤用铂电极电解CuSO4溶液⑥用铂电极电解Na2SO4溶液。当在相同的时间内通相同强度的电流时:(用序号填写)
(1)溶液中c(H+)增大的是_________________________________________;
(2)溶液中pH增大的是___________________________________________;
(3)溶液中c(H+)基本不变的是______________________________________;
(4)析出气体总体积最大的是_______________________________________;
(5)阴极析出金属质量最大的是_____________________________________。
粗铜中常含有锌、镍、银、金等杂质,工业上常用电解的方法精炼粗铜。
(1)电解时__________作阳极,电极反应式为_______________________;作阴极,电极反应式为_________________________。
(2)电解前CuSO4溶液的浓度为1 mol·L-1,电解时如有0.5 mol电子发生转移,则此时电解液中CuSO4的浓度为,阴极得到的纯铜质量为。阳极泥的主要成分是__________________。
将铝件与另一种材料作电极,以某种溶液作电解液进行电解,通电后在铝件与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电流从小孔通过并产生热量使Al(OH)3分解,从而在铝件表面形成一层较厚的氧化膜。某校研究性学习小组根据上述原理,以铝件和铁棒为电极,一定浓度的NaHCO3溶液为电解液进行实验。
(1)铝件表面形成氢氧化铝薄膜的电极反应式为____________________。
(2)电解过程中,必须使电解液pH保持相对稳定(不能太大,也不能太小)的原因是__________________________
(3)使用NaHCO3溶液为电解液,会减缓阴极区溶液pH的增大,能说明这一原理的离子方程式为____________________。
塑料电镀是近几十年来发展起来的表面处理新技术,广泛用于电子、家用电器、汽车、建筑等工业。它先是在塑料、陶瓷等非金属表面采用化学沉积的方法沉积出一层金属层,再用电解的方法镀上铜层,电解液为CuSO4水溶液。
(1)请写出电解时,阴极上可能发生的反应:
①______________________________________;②___________________________________。
(2)设通过268 mA的电流60 min后,阴极上沉积出铜0.2879 g,阴极上还可能放出的气体是;该气体在标准状况下的体积是。
请判断下图所示的装置中,A、B、C各是什么池。
A_____________________________________;
B_____________________________________;
C_____________________________________。