目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: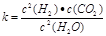 它所对应的化学反应为:__ ___
它所对应的化学反应为:__ ___
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 |
容积/L |
温度/℃ |
起始量/mol |
平衡量/mol[ |
达到平衡所需时间/min |
|
| C(s) |
H2O(g) |
H2(g) |
||||
| 甲 |
2 |
T1 |
2 |
4 |
3.2 |
8 |
| 乙 |
1 |
T2 |
1 |
2 |
1,2 |
3 |
①T10C时,该反应的平衡常数K=_______
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度_______ (填选项字母)。
A.="0.8" mol·L-1 B.=1.4 mol·L-1 C.<1.4 mol·L-1 D.>1.4 mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平 衡时各气体的体积分数与甲容器完全相同的是_______(填选项字母)。
A.0.6 mol、1.0 mol、0.5 mol、1.0 mol
B. 0.6 mol、2.0 mol、0 mol、0 mol
C.1.0 mol、2.0 mol、1.0 mol、2.0 mol
D. 0.25 mol、0.5 mol、0.75 mol、1.5 mol
(3)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,已知CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: 。
(4)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+ 6H2(g)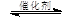 CH3OCH3(g)+ 3H2O(g)
CH3OCH3(g)+ 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2)/ n(CO2)] |
500 K |
600 K |
700 K |
800 K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
①该反应的焓变△H 0,熵变△S___0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。
(9分)某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究。
(1)实验室制取氨气的化学方程式为。
(2)某同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的?(填“能”或“否”),理由是。
(3)该小组的同学设计了如图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性。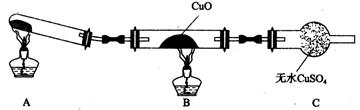
①该装置在设计上有一定缺陷。为保证实验结果的准确性,对该装置的改进措施是
。
②利用改进后的装置进行实验,CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。氨气与CuO反应的化学方程式为。
③有同学认为NH3与CuO反应生成的红色物质中可能含Cu2O。Cu2O在酸性溶液中Cu+歧化生成Cu和Cu2+。请设计一个简单的实验检验该红色物质中是否含有Cu2O
。
(9分)明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下: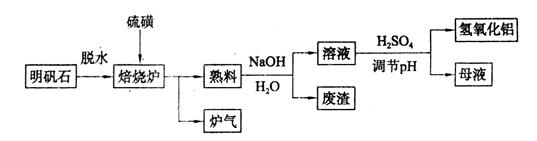
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S 2Al2O3+9SO2,该反应的氧化剂是_______,若生成1 mol Al2O3,则转移的电子数为_______。
2Al2O3+9SO2,该反应的氧化剂是_______,若生成1 mol Al2O3,则转移的电子数为_______。
(2)将标况下1.12L炉气通入100mL 0.5/L NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为_______________ _______。
(3)熟料溶解时反应的离子方程式为___________________________________。
(4)检验废渣中含有Fe2O3所需的试剂是____________。
(5)母液中溶质主要成分的化学式为__________,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是_________________________。
(10分)A、B、C、D、E、F、G七种元素的原子序数依次递增。已知:
①G的原子序数为29,其余的均为短周期主族元素;
②A是宇宙中含量最多的元素,B原子最外层电子数是次外层电子数的2倍,C原子核外有三个未成对电子;
③D和E原子价电子排布式均为ns2np4;④F的单质是黄绿色气体。
请回答下列问题:
(1)G2+的核外电子排布式是。在[G(NH3)4]2+离子中,G2+与NH3分子形成的是键。
(2)与B、C形成的阴离子(BC—)互为等电子体的微粒有、(分子和离子各写一种)。
(3)B与C形成的化合物中,下列判断正确的是。
a.氢化物稳定性:B>C b.氢化物沸点:B<C
c.最高价氧化物的水化物酸性:B<Cd.非金属性:B>C
(4)B、C、D第一电离能由小到大的顺序为(用元素符号作答),B的一种氢化物相对分子质量为26,分子中的σ键与π键数目比为。
(5)七种元素中,电负性最大的元素与B元素形成化合物电子式为,该物质的晶体属于。
松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(下式中的18是为区分两个羟基而人为加上去的)经下列反应制得:
(1)α-松油醇的分子式
(2)α-松油醇所属的有机物类别是
(a)醇(b)酚(c)饱和一元醇
(3)α-松油醇能发生的反应类型是
(a)加成(b)水解(c)氧化
(4)在许多香料中松油醇还有少量以酯的形式出现,写出RCOOH和α-松油醇反应的化学方程式。
(5)写结构简式:β-松油醇,γ-松油醇。
X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X原子基态时最外层电子数是其内层电子数的2倍 |
| Y |
Y原子基态时2p原子轨道上有3个未成对的电子 |
| Z |
Z的基态原子最外层电子排布式为:nsnnpn+2 |
| W |
W的原子序数为29 |
(1)基态W原子的价电子排布式是_________________。
(2)X、Y、Z三种元素第一电离能从大到小的顺序是____________。(填化学式)
(3)Y的氢化物分子的空间构型是_______________;该氢化物分子中Y原子轨道的杂化类型是___________。
(4)X的气态氢化物和Y的气态氢化物中沸点高的是,(填化学式)其主要原因是。
(5)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。