运用化学反应原理研究NH3的性质具有重要意义。请回答下列问题:
(1)氨气、空气可以构成燃料电池.其电池反应原理为4NH3+3O2=2N2+6H2O。则电解质溶液应该显 (填“酸性”“中性”或“碱性”).正极的电极反应式为 。
(2)25℃时.将amol·L—1的氨水与0.1mol·L—1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-))时.则反应的情况可能为 。
A.盐酸不足.氨水剩余 B.氨水与盐酸恰好完全反应 C.盐酸过量
②当溶液中c(NH4+)=c(Cl-))时.用含“a”的代数式表示NH3·H2O的电离平衡常数Kb=______________.
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g) 2NH3(g) ∆H=bkJ/mol,其化学平衡常数K与温度的关系如下:
2NH3(g) ∆H=bkJ/mol,其化学平衡常数K与温度的关系如下:
| 温度/℃ |
200 |
300 |
400 |
| K |
1.0 |
0.86 |
0.5 |
①写出该反应的化学平衡常数的表达式:__________,b________(填“大于”“小于”或“等于”)0
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)_________(填“大于”“小于”或“等于”)v逆(N2).
(4)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ∆H="-1266.8KJ/mol" ;②N2(g)+O2(g)=2NO(g) ∆H=+180.5KJ/mol,写出氨高温催化氧化的热化学方程式: 。
20℃时,醋酸的电离平衡常数为1.6×10-5。
(1)试计算20℃时0.01mol•L-1的醋酸溶液中氢离子浓度。
(2)室温时,向0.2mol•L-1的醋酸溶液中加入等体积的0.1mol•L-1的NaOH(aq),充分反应后所得溶液的PH=4,则:
①所得溶液中各离子(包括CH3COOH分子)浓度大小关系是:______________________,
②所得溶液中的物料守恒式为:________+________=__________=_________mol•L-1。
③c(CH3COOH)=_____________mol•L-1(写出算式,不做近似计算)
将镁铝的混合物0.1mol溶于100ml 2mol/L硫酸溶液中,然后再滴加1mol/L的NaOH溶液,请回答:
(1)若在滴加NaOH溶液过程中,沉淀质量随加入NaOH溶液的体积变化如图所示,当V1=160mL时,则金属粉末中n(Mg)=mol, V2=mL,
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积 V(NaOH) =mL
V(NaOH) =mL
(3)图像中A点的意义是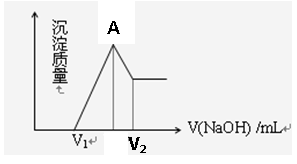
已知在含HNO3的溶液中放入Al不生成H2。某无色透明溶液跟金属铝反应放出H2。试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO32-、SO42-、HCO3-、OH-、NO3-,在下列两种情况下何者能存在于溶液中。
(1)当生成Al3+时,可能大量存在_________________________________________________。
(2)当生成 时,可能大量存在_______________________________________________。
时,可能大量存在_______________________________________________。
取两等份铝粉,第一份加入250 mL 2 mol·L-1的盐酸,第二份加入400 mL2mol·L-1的烧碱。若同温同压下放出气体体积之比为5:6,则加入的铝粉每份质量为。
(10分) 将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如右图所示。当V1=140mL时,则金属粉末中n(Mg)= mol,V2= mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入480 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:
(4)若滴加NaOH溶液致V2ml时,停止滴加NaOH溶液,开始往溶液中通入足量CO2,请写出发生反应的离子方程式——————————————————————-————。