下列各表述与示意图一致的是
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2SO2 (g) + O2(g)
图②中曲线表示反应2SO2 (g) + O2(g) 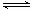 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间 的变化(注:Mn2+是该反应的催化剂)
的变化(注:Mn2+是该反应的催化剂)
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
下列反应的离子方程式正确的是()
| A.碳酸氢钙溶液中加入足量的苛性钠溶液:Ca2++HCO3---+OH---=CaCO3↓+H2O |
B.电解饱和食盐水: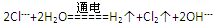 |
| C.氯气通入冷的氢氧化钠溶液中:2Cl2+2OH---=3Cl---+ClO---+H2O |
| D.FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl--- |
室温下,下列各组离子在指定溶液中一定能大量共存的是()
A.饱和氯水中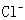 、 、 、 、 、 、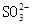 |
B. 溶液中 溶液中 、 、 、 、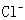 、Fe3+ 、Fe3+ |
C.pH=13的溶液中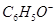 、 、 、 、 、 、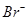 |
D.由水电离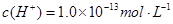 溶液中 溶液中 、 、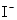 、 、 、 、 |
下列装置可用于收集SO2并验证其某些化学性质,下列说法正确的是()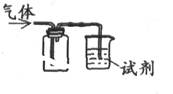
| 选项 |
试剂 |
现象 |
结论 |
|
| A |
酸性KMnO4溶液 |
溶液褪色 |
SO2有氧化性 |
|
| B |
品红溶液 |
溶液褪色 |
SO2有漂白性 |
|
| C |
NaOH溶液 |
无明显现象 |
SO2与NaOH溶液不反应 |
|
| D |
紫色石蕊试液 |
溶液变红后不褪色 |
SO2有酸性、没有漂白性 |
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3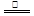 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是( )
| A.C3N3(OH)3与HNCO为同一物质 |
| B.HNCO是一种很强的氧化剂 |
| C.1 mol NO2在反应中转移的电子为24 mol |
| D.反应中N2既是氧化产物又是还原产物 |
滴有酚酞试液的下列溶液,操作后颜色变深的是()
| A.明矾溶液加热 | B.小苏打溶液中加入少量NaCl固体 |
| C.氨水中加入少量NH4Cl固体 | D.Na2CO3溶液加热 |