二十一世纪世界资源争夺的重点是海洋。海底有石油、可燃冰、石油气、矿砂、锰结核的资源,海水中除有渔业资源外,还有食盐、溴、碘等许多化学资源,所有资源中最丰富的是水资源。
(1)海水中质量分数最高的元素是氧,该元素的原子核外电子占据的轨道共有________个能级,有________个未成对电子。
(2)水的沸点为100℃,氟化氢的沸点为19.5℃,水与氟化氢比较,稳定性较强的是_ _______。水的沸点比硫化氢高,其原因是___________________。
_______。水的沸点比硫化氢高,其原因是___________________。
(3)提取碘是将海带灼烧成灰,溶于水过滤,滤液中通入氯气,反应的离子方程式为_______________________________,再用四氯化碳将生成的单质碘______(填写实验操作名称)出来,最后用_________(填写实验操作名称)使碘和四氯化碳分离。
(4)海洋元素中的氯、溴、碘统称为海水中的卤素资源,它们的最外层电子排布都可表示为_____________________。
在 NaCl与MgCl2的混合液中,Na+与Mg2+的物质的量之比为1:2。如果混合液中共有0.5 mol Cl-,溶液的体积为0.5 L,则混合液中氯化钠的质 量为;MgCl2的物质的量浓度为。
量为;MgCl2的物质的量浓度为。
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
⑴海水中含有大量的氯化钠。请写出氯离子结构示意图。
⑵目前国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是(填物理变化、化学变化)。
⑶工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的化学方程式为。
⑷ 近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫 的方法,该方法的流程如下:
的方法,该方法的流程如下:
已知SO2和CO2都属于酸性氧化物,试写出②④的化学反应方程式:
②__________________________________;④____________ _________________________。
_________________________。
一个完整的氧化还原反应方程式可以拆开写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如 的拆写结果是
的拆写结果是 :氧化反应为:
:氧化反应为: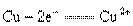 ;还原反应为:
;还原反应为: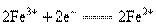 。
。
①请据此将反应:Fe + 4H+ + NO3- = Fe3+ + NO↑ + 2H2O拆写成两个“半反应式”:氧化反应为____________________;还原反应为____________________。
②已知某一氧化还原反应为:CH4+ 2OH- + 2O2 = CO32- + 3H2O;其中氧化反应的半反应可写为: ,则还原反应的半反应可写为___________________。
,则还原反应的半反应可写为___________________。
氧化还原反应有多种分类方法,其中根据参与电子转移的元素种类不同的分类方法最常见。下列所提供的反应中电子转移发生在相同价态的同种元素之间的有(填序号,下同);电子转移发生在不同价态的同种元素之间的有;电子转移发生在不同元素之间的有。
①C+CO2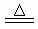 2CO②NH4NO3
2CO②NH4NO3 N2O↑+2H2O③2KClO3
N2O↑+2H2O③2KClO3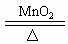 2KCl+3O2↑
2KCl+3O2↑
④S+2KNO3+3C K2S+N2↑+3CO2↑⑤3Cl2+6NaOH
K2S+N2↑+3CO2↑⑤3Cl2+6NaOH 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
⑥HgS+O2 Hg+SO2
Hg+SO2
在下列反应中:
| A.2F2+2H2O=4HF+O2 | B.2Na+2H2O=2NaOH+H2↑ |
| C.CaO+H2O=Ca(OH)2 | D.2H2O=2H2↑+O2↑ |
水只作氧化剂的是,水只作还原剂的是,水既作氧化剂又 作还原剂的是,水既不作氧化剂又不作还原剂的是。
作还原剂的是,水既不作氧化剂又不作还原剂的是。