(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
| 烯类化合物 |
相对速率 |
| (CH3)2C=CHCH3 |
10.4 |
| CH3CH=CH2 |
2.03 |
| CH2=CH2 |
1.00 |
| CH2=CHBr |
0.04 |
下列化合物与溴加成时,取代基对速率的影响与表中规律类似,其中反应速率最快的是_______________(填序号);
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3 C.CH2="CH" CH3 D.CH2=CHBr
(2)0.5mol某炔烃最多能与1molHCl发生加成反应得到氯代烃,生成的氯代烃最多能与3mol Cl2发生取代反应,生成只含C、Cl两种元素的化合物。则该烃的结构简式是 ;
(3)某芳香烃A,其相对分子质量为104,碳的质量分数为92.3%。
①A分子中可能共平面的碳原子最多有 个;
②芳香烃A在一定条件下可生成加聚高分子,该高分子结构中的链节为 ;
③一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出形成该化合物的有机反应方程式 ;
④已知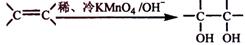 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式 。
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式 。
已知一定温度和压强下,在容积为VL的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g) + B(g)  C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
(1)升温时,C的反应速率_______(填“加快”、“减慢”或“不变”)。
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡_______。
| A.一定向正反应方向移动 | B.一定向逆反应方向移动 |
| C.一定不移动 | D.不一定移动 |
(3)若使温度、压强在上述条件下恒定不变,在密闭容器中充入2mol A和2 mol B,则反应达到平衡时,C的体积分数为_______;气体的总体积为______。
现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号) 。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 。
(4)已知t℃,KW=1×10-13,在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中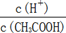 的比值将________(填“增大”、“减小”或“无法确定”)。
的比值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙)(填“大于”、“小于”或“等于”,下同)。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)________V(乙)。
高温下CuO(s)+CO(g) Cu(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:1000℃ K=4.0 1150℃ K=3.7 1300℃ K=3.5 ;请回答下列问题:
Cu(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:1000℃ K=4.0 1150℃ K=3.7 1300℃ K=3.5 ;请回答下列问题:
(1)该反应的平衡常数表达式___________.
(2)在一个容积为2L的密闭容器中,1000℃时加入Cu、 CuO、CO、CO2各0.2 mol,反应经过10min后达平衡。求该时间范围内反应的平均反应速率v(CO2)﹦ 。
(3)以下措施中,能使反应(2)中的正反应速率显著加快同时不影响CO的平衡转化率的是 (填字母序号)。
A、增加CO的浓度
B、增加CuO的量
C、移出部分CO2
D、提高反应温度
E、减小容器的容积
(4)1000℃时测得在2L的密闭容器中反应体系中某时刻各物质的物质的量见下表:
| CuO |
CO |
Cu |
CO2 |
| 0.8mol |
0.4mol |
0.6mol |
0.6mol |
此时反应中正、逆反应速率的关系式是 (填代号)。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。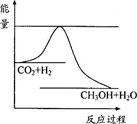
(1)关于该反应的下列说法中,正确的是_______。
| A.△H>0,△S>0; | B.△H>0,△S<0; |
| C.△H<0,△S<0; | D.△H<0,△S>0。 |
(2)该图中能量的最高点和最低点之间的差值代表
(3)以CH4和H2O为原料,通过下列反应来制备甲醇。
① CH4(g)+H2O(g) ="=" CO(g)+3H2(g) △H=+206.0KJ/mol
② CO(g) + 2H2(g) ="=" CH3OH(g) △H=-129.0KJ/mol
CH4(g)和H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 。