某校化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥、纯净的氯气。为防止换集气瓶时生成的氯气污染空气,设计了如下装置: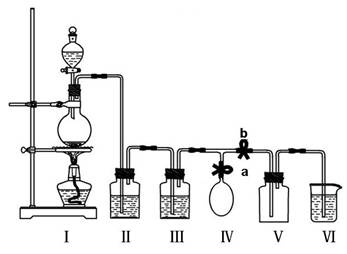
(1)写出装置Ⅰ烧瓶中发生反应的化学方程式: ,写出氯原子结构示意图 ;
(2)装置Ⅱ中盛放的药品是饱和氯化钠溶液,其作用是 ;
装置Ⅲ的作用是干燥氯气,应盛放 。
(3)实验开始后,先 a b(填“关闭”或“打开”,下同);当集满一瓶氯气时,为减少换集气瓶时氯气的外逸,再 a b,换好集气瓶后,继续收集氯气。
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中不恰当的 (填字母)
A.氢氧化钠溶液 B.浓硫酸 C.水
硫醇-烯具有反应过程相对简单、反应过程可控等优点,成为近年来有机合成的研究热点之一,如反应①:
(1)化合物I的分子式为______________,反应①的反应类型为______________。
(2)化合物Ⅱ与Br2加成的产物的结构简式为______________。
(3)化合物Ⅲ的氧化产物化合物Ⅳ能发生银镜反应,则Ⅲ的结构简式为_________。化合物Ⅳ与新制Cu(OH)2反应的化学方程式____________________________。
(4)化合物Ⅲ的一种同分异构体Ⅴ有如下特征:a.含有苯环,且苯环上有两个取代基;b.能与FeCl3溶液发生显色反应;c.核磁共振氢谱显示存在5组峰,峰面积之比为1∶1∶2∶2∶6。化合物Ⅴ的结构简式为____________。
化合物M是一种治疗心脏病药物的中间体。以A为原料的工业合成路线如下图所示。己知:RONa+R′Cl→ROR′+NaCl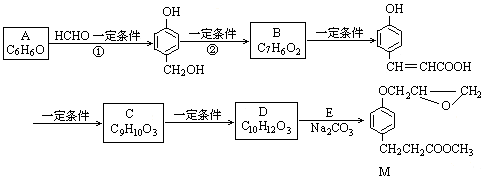
根据题意完成下列填空:
(1)写出反应类型。反应①反应②
(2)写出结构简式。AC
(3)写出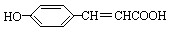 的邻位异构体分子内脱水产物香豆素的结构简式。
的邻位异构体分子内脱水产物香豆素的结构简式。
(4)由C生成D的另一个反应物是,反应条件是。
(5)写出由D生成M 的化学反应方程式。
(6)A也是制备环己醇( )的原料,写出检验A已完全转化为环己醇的方法。
)的原料,写出检验A已完全转化为环己醇的方法。
X、Y、Z、Q、W、R六种短周期元素原子序数依次增大,化合物甲由X、Z、Q三种元素组成,常温下0.1mol/L甲溶液的pH=13,工业上常用电解饱和QR溶液生成甲;化合物乙由X、R两种元素组成。请回答以下问题:
(1)Q的原子结构示意图为。
(2)Y元素的单质能发生如图所示的转化,则Y元素为(用元素符号表示)。在甲溶液中通入足量YZ2气体,所得溶液呈碱性,原因是(用离子方程式和必要的文字说明)。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
①常温下,将W的单质和甲溶液混合,发生反应的离子方程式为:
②Q、W两种元素金属性的强弱为QW(填“>”、“<”) ;下列表述中证明这一事实的是。
a.Q的单质的熔点比W单质低
b.Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
c. W的原子序数大
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知:H2(g)、CO(g)和CH3OH(1)的燃烧热△H分别为-285.8 kJ .
.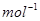 、一283.0 kJ
、一283.0 kJ 和一726.5.kJ
和一726.5.kJ 。请回答下列问题:
。请回答下列问题:
(1)用太阳能分解10mol H2O(1)消耗的能量是________kJ.
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:
__________________________________________________________________________.
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,
考查温度对反应的影响,实验结果如下图所示(注: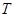 、
、 均大于300℃):
均大于300℃):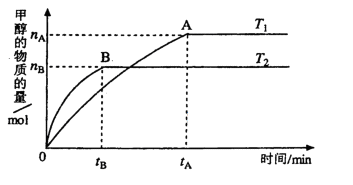
下列说法正确的是_______________(填序号)
①温度为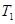 时,从反应开始到反应达到平衡,生成甲醇的平均速率为:
时,从反应开始到反应达到平衡,生成甲醇的平均速率为: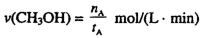
②该反应在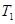 时的平衡常数比
时的平衡常数比 时的小
时的小
③该反应为放热反应
④处于A点的反应体系的温度从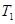 变到
变到 ,达到平衡时
,达到平衡时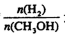 增大
增大
(4)在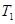 温度时,将1mol CO2和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则此时容器内的压强与起始压强之比为___________。
温度时,将1mol CO2和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则此时容器内的压强与起始压强之比为___________。
(5)在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,负极的反应式为___________________;正极的反应式为_____________________________________.理想状态下,该燃料电池消耗lmol甲醇所能产生的最大电能为701.8kJ,则该燃料电池的理论效率为_______________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
丙烯可用于合成杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂: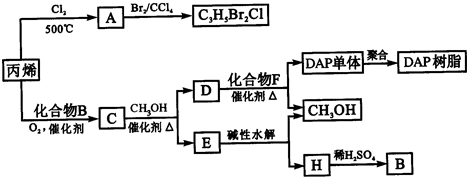
已知酯与醇可发生如下酯交换反应: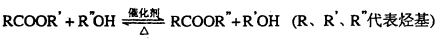
(1)农药C3H5Br2Cl分子中每个碳原子上均连有卤原子。
A的结构简式是__________________;A中所含官能团的名称是____________________。
丙烯→A的反应类型是_______________;A→C3H5Br2CI的反应类型是_____________。
(2)A水解可得到D.该水解反应的化学方程式为:
_______________________________________________________________________.
(3)C蒸气密度是相同状态下甲烷密度的6.25倍,S中各元素的质量分数分别为:碳60%,氢8%,氧32%. S的结构简式为_________________________________.
(4)下列说法正确的是______________(填字母代号)。
a.C能发生聚合反应、还原反应和氧化反应
b.C含有2个甲基的羧酸类同分异构体有4个
c.D催化加氢的产物与B具有相同的相对分子质量
d.E具有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环利用于DAP树脂的制备。其中将甲醇与H分离的操作方法是__________________。
(6)F的分子式为C10H10O4.。DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。足量D和F反应生成DAP单体的化学方程式为:
_______________________________________________________________________.
(7)实验室由2-丙醇制备丙烯时,还产生少量SO2、 CO2及水蒸气,某同学用以下试剂
检验这四种气体,混合气体通过试剂的顺序是_______________(填序号)。
①饱和Na2SO3溶液②酸性KMnO4溶液③石灰水④无水CuSO4⑤品红溶液