由几种化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-。将该混合物溶于水后得澄清溶液,现各取三份100 mL该溶液分别进行如下实验:
| 实验序号 |
实验内容 |
实验结果 |
| 1 |
加入AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L (标准状况下) |
| 3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量,再向沉淀中加入足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27 g, 第二次称量读数为2.33 g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”),根据实验1~3判断混合物中一定不存在的离子是 。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满)。
| 阴离子符号 |
物质的量浓度(mol·L-1) |
| |
|
| |
|
| |
|
(3)试确定K+是否存在 (填“存在” 或“不存在”),判断的理由是
。
【化学—有机化学基础】
已知:通常羟基与烯键碳原子相连接时,易发生下列转化:
现有下列所示的转化关系:
已知:B、G均能发生银镜反应,C能与浓溴水发生反应产生白色沉淀,C的核磁共振氢谱中只出现4组峰。E能使溴水褪色。请回答:
(1)结构简式:A;F;
(2)写出③的反应类型;
(3)完成下列反应的化学方程式:
反应③;反应④。
【化学—物质结构与性质】
已知a、b、x、y、z五种元素的原子序数依次增大,其中a原子的半径是所有原子中半径最小的,b原子中的电子有6种不同的运动状态,y原子的L层有2对成对电子,z元素的电负性是前四周期中最小的。
(1)x、y两种元素的第一电离能的大小为xy(填“>”、“<”或“=”),用原子结构的知识解释原因;
(2)固体物质M的化学式为x a 5,它的所有原子最外层都符合相应的稀有气体原子的最外电子层结构。则该化合物中a元素的化合价为和;该化合物中x原子的杂化方式为 ;
(3)如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,z原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。现把C60 抽象成质点,该晶体的晶胞结构如图所示,若每个四面体空隙填入一个z元素的原子,则 z元素全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为。
【化学—化学与技术】
碘酸钾是一种白色结晶,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘;在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560 ℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:6I2 +11KClO3 +3H2O=6KH(IO3)2 + 5KCl + 3Cl2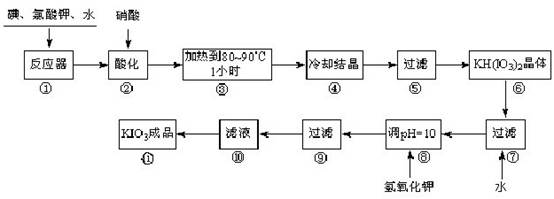
试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为___________;
(2)步骤②中,用硝酸而不用HI,其原因可能是______________________;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________;
(4)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为:________;
碳和氮的许多化合物在工农业生产和生活中有重要的作用。
(1)用CO2 和H2 合成CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机。已知: +
+
 =
=  + 2
+ 2 △H = -725.5 kJ·mol-1
△H = -725.5 kJ·mol-1
2H2 (g)+O2(g) = 2H2O(l)△H = -565.6 kJ·mol-1,
请写出工业上用CO2 和H2 合成CH3OH(l)的热化学方程式:;
(2)一种新型燃料电池,一极通入空气,一极通入CH3OH(g),电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。则在该熔融电解质中,O2-向(填“正”或“负”)极移动,电池负极电极反应为: ;
(3)如图是一个电化学装置示意图。用CH3OH-空气燃料电池做此装置的电源。如果A是铂电极,B是石墨电极,C是CuSO4溶液,通电一段时间后,向所得溶液中加入8 g CuO固体后恰好可使溶液恢复到电解前的浓度和pH.则电解过程中收集到标准状况下的气体体积为;
(4)常温下0.01 mol·L-1的氨水中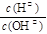 = 1×10- 6 ,则该溶液的pH为____,溶液中的溶质电离出的阳离子浓度约为;将 pH = 4的盐酸溶液V1 L与 0.01 mol·L-1氨水V2 L混合,若混合溶液pH = 7,则V1和V2的关系为:V1V2(填“>”、“<”或“=”)。
= 1×10- 6 ,则该溶液的pH为____,溶液中的溶质电离出的阳离子浓度约为;将 pH = 4的盐酸溶液V1 L与 0.01 mol·L-1氨水V2 L混合,若混合溶液pH = 7,则V1和V2的关系为:V1V2(填“>”、“<”或“=”)。
已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质;Y在常温下为液态,E的相对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去):
请回答下列问题:
(1)B的化学式为;F与Cu反应的离子方程式为_________;
(2)C可与过量的Cl2反应生成HCl和物质A,A可发生水解反应生成NH3 和HClO,则C与过量Cl2 反应的化学方程式为,反应中的还原剂为;
(3)D气体和CO都是汽车尾气的主要成分,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2D(g) + 2CO(g)  N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
①该反应的化学平衡常数为 K =;
②若保持温度不变,20 min 时再向容器中充入CO、N2
各0.8 mol,平衡将移动(填“向左”、“向右”或“不”)
③20 min时,若改变反应条件,导致CO浓度发生如图
所示的变化,则改变的条件可能是(填序号);
a.缩小容器体积 b.增加CO2的量
c.升高温度 d.加入催化剂