已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质;Y在常温下为液态,E的相对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去):
请回答下列问题:
(1)B的化学式为 ;F与Cu反应的离子方程式为_________;
(2)C可与过量的Cl2反应生成HCl和物质A,A可发生水解反应生成NH3 和HClO,则C与过量Cl2 反应的化学方程式为 ,反应中的还原剂为 ;
(3)D气体和CO都是汽车尾气的主要成分,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2D(g) + 2CO(g)  N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
①该反应的化学平衡常数为 K = ;
②若保持温度不变,20 min 时再向容器中充入CO、N2
各0.8 mol,平衡将 移动(填“向左”、“向右”或“不”)
③20 min时,若改变反应条件,导致CO浓度发生如图
所示的变化,则改变的条件可能是 (填序号);
a.缩小容器体积 b.增加CO2的量
c.升高温度 d.加入催化剂
某芳香烃A是有机合成中非常重要的原料,通过质谱法测得其最大质荷比为118;其核磁共振氢谱中有5个峰,峰面积之比为1:2:2:2:3;其苯环上只有一个取代基。以下是以A为原料合成高分子化合物F、I的路线图,试回答下列问题: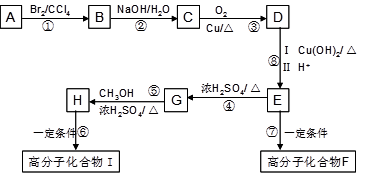
(1)A的结构简式为(2)E中的官能团名称是
(3)G的结构简式为(4)反应②、④的反应类型分别是
(5)反应⑥、⑦生成的高分子化合物的反应原理是否相同?
(6)写出下列反应的化学方程式:
反应③;反应⑦
(7)符合以下条件的C的同分异构体有种(不考虑立体异构)
a、苯环上有两个取代基
b、苯环上的一氯代物有两种
c、加入三氯化铁溶液显色
d、向1mol该物质中加入足量的金属钠可产生1mol氢气
A、B、C、D、E五种溶液分别是HCl、CH3COOH、NaOH、NH3.H2O、Na2CO3溶液中的一种。常温下进行下列实验:
①将1L PH=9的A溶液分别与xL 0.001mol/L B溶液、yL 0.001mol/L D溶液充分反应后溶液呈中性,x、y大小关系为:y<x;
②浓度均为0.1 mol/L C与D溶液等体积混合,溶液呈酸性;
③浓度均为0.1 mol/L A和E溶液的PH:A< E
回答下列问题:
(1)E的电子式
(2)写出A与足量B溶液反应的离子方程式
(3)将等体积、等物质的量浓度的D、E分别与足量的铝粉反应,产生H2的物质的量之比为
(4)将等体积、等物质的量浓度的B和C混合后,所得溶液的PH约为7,原因是
(5)室温时在一定体积0.4 mol/L的E溶液中,加入一定体积的0.1 mol/L的D溶液时,混合溶液PH=13,若混合后溶液的体积变化忽略不计,则D、E溶液的体积之比是
某化工厂将钛、氯碱工业和甲醇制备联合生产,大大提高原料利用率,并减少环境污染。流程如下:
回答下列问题:
(1)写出以石墨为电极电解饱和食盐水的离子方程式
(2)写出钛铁矿在高温下与焦炭经氯化得四氯化钛的化学方程式,生成1mol四氯化钛时转移电子的物质的量为mol
(3)利用四氯化钛制备TiO2.xH2O时,需加入大量的水并加热的目的是
(4)钛广泛用于航天领域。氩气在冶炼钛的流程中的作用是
(5)利用CO和H2制备甲醇
①已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol。写出CO和H2制备甲醇的热化学方程式
②假设联合生产中各原料利用率为100%,若得到6mol甲醇,则只需再补充标准状况下的H2L
“百度百科:乙醇,俗称酒精,在常温、常压下是一种易燃、易挥发的无色透明液体,它的水溶液具有酒香的气味,并略带刺激性,微甘。易燃,能与水以任意比互溶。用途很广,可用制造饮料、染料、燃料等。在国防工业、医疗卫生、有机合成、食品工业、工农业生产中都有广泛的用途。”根据所学知识回答下列问题
(1)书写乙醇催化氧化的产物和新制银氨溶液反应的化学方程式:
(2)在120℃,101kpa条件下,取ag乙醇在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量增加了bg,则ab(填“=”“>”“<”)
(3)乙醇燃料电池,KOH作电解质,书写负极电极反应式:
(4)请用所学知识解释为什么乙醇能和水以任意比互溶
亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3。
(1)亚磷酸是_______元酸。
(2)PCl3水解可制取亚磷酸:PCl3+3H2O=_________
(3)H3PO3溶液中存在电离平衡:H3PO3 H++H2PO3-
H++H2PO3-
①某温度下,0.10mol∙L-1的H3PO3溶液pH=1.6,即溶液中c(H+)=2.5×10-2mol∙L-1。求该温度下上述电离平衡的平衡常数K=_______。(只考虑H3PO3的第一步电离,结果保留两位有效数字。)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH_____7(填“>”“=”“<”)
(4)亚磷酸具有还原性,可使碘水褪色。该反应的化学方程式为_______________。
(5)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下: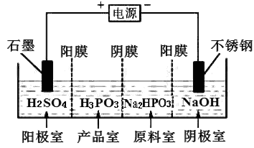
①阴极的电极反应式为__________。②产品室中反应的离子方程式为__________________。