研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1,
C(s)+CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式: 。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度
下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
测得CH3OH的物质的量随时间的变化见图。
①
|
曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。

| 容 器 |
甲 |
乙 |
| 反应物投入量 |
1molCO2、3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图。在其他条件不变时,请在右图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图。
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图。在其他条件不变时,请在右图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图。

为了证明一水合氨(NH3·H2O)是弱电解质,常温下,甲、乙、丙三人分别选用下列试剂进行实验:0.010 mol/L氨水、0.1 mol/L NH4Cl溶液、NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水.
(1)甲用pH试纸测出0.010 mol/L氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?________(填“是”或“否”),并说明理由
___________________________________________________________________
(2)乙取出10 mL 0.010 mol/L氨水,用pH试纸测出其pH=a,然后用蒸馏水稀释至1 000 mL ,再用pH试纸测出其pH为b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系______________________.(用等式或不等式表示).
(3)丙取出10 mL、0.010 mol/L氨水,滴入2滴酚酞溶液,显粉红色,再加入NH4Cl晶体少量,颜色变_____(填“深”或“浅”).你认为这一方法能否证明NH3·H2O是弱电解质?________(填“能”或“不能”)并说明原因: ____________________.
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3·H2O是弱电解质:
________________________________________________________________________.
下表是不同温度下水的离子积的数据:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积 |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),做此判断的理由是
____________________________________________________________.
(2)25℃时,某Na2SO4溶液中c(SO)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,
则稀释后溶液中c(Na+)∶c(OH-)=________.
(3)在t2温度下测得某溶液pH=7,该溶液显______(填“酸”、“碱”或“中”)性.将此温
度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合.
①若所得混合液为中性,则a∶b=________.
②若所得混合液pH=2,则a∶b=________.
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________.
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
(2)该反应达到平衡时若缩小体积,则混合气体的平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”).
(3)该条件下反应__________________(填“能”或“不能”)自发进行.
(4)在如图中画出在某时刻条件改变后的图象(其他条件不变).
t1:增大NO的浓度
t2:降低温度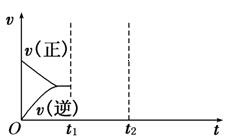
分子式为C12H14O2的F有机物广泛用于香精的调香剂。
已知:① R-CH2X + NaOH 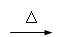 R-CH2OH + NaX(X代表卤素原子)
R-CH2OH + NaX(X代表卤素原子)
②
为了合成该物,某实验室的科技人员设计了下列合成路线:
试回答下列问题:(1)A物质在核磁共振氢谱中能呈现 种峰;C物质的官能团名称_____________;E物质的结构简式_____________;
(2)上述合成路线中属于取代反应的是(填编号);
(3)反应④的化学方程为;
(4)写出E属于芳香族化合物所有的同分异构体。
X、Y、Z、Q、E、F六种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在第二周期主族元素中电负性最大的元素。请回答下列问题:
(1)XZ2与YZ2分子的立体结构分别是和,相同条件下两者在水中的溶解度较大的是(写分子式),理由是;
(2)Q的元素符号是,它的核外电子排布式为,在形成化合物时它的最高化合价为;
(3)用氢键表示式写出E的氢化物溶液中存在的所有氢键。
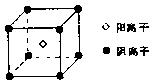
(4)F的氢化物是一种碱性气体,F还可与氢形成离子化合物FH5,其电子式为;其晶体的最小结构单元如图所示,经实验测得FH5晶体的密度为dg/cm3,阿伏加德罗常数用NA表示,则该晶体中阴离子与阳离子之间的最短距离为cm。