能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ · mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ · mol-1
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质中自由移动。
下列说法中正确的是_____________(填字母序号)。
| A.负极的电极反应式为:CO + O2-―2e-=CO2 |
| B.工作时电子由电极a通过传感器流向电极b |
| C.工作时电极b作正极,O2-由电极a通过固体介质向电极b迁移 |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
(3)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为______________。
(4)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向1 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
| 物 质 |
CO |
H2 |
CH3OH |
| 浓度/(mol·L-1) |
1.2 |
1.0 |
0.6 |
①该反应的平衡常数表达式为:K=_____________________。
②该时间内反应速率v(H2)=_________________。
③平衡时CO的转化率为_________________(保留1位小数)。
有A、B、C、D、E五种金属元素,在相同的条件下,B的最高价氧化物对应的水化物的碱性比A的最高价氧化物对应的水化物的碱性强,A、B都可以从盐溶液中置换出C;D与冷水剧烈反应并放出氢气,A、B、C、E四种金属分别投入到盐酸中,只有E不放出氢气,则这五种金属元素的金属性由强到弱的顺序为
向一定体积的密闭器中加入2 mol A、0.6 mo1 C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图(Ⅰ)所示,其中t0~t1阶段c(B)未画出.图(Ⅱ)为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中t3~t4阶段为使用催化剂.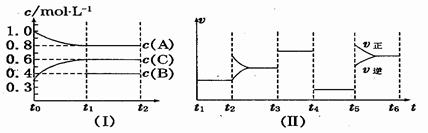
请回答下列问题:
(1)若t1=15 min,则t0~t1阶段以C物质的浓度变化表示反应速率为。
(2) t4~t5阶段改变的条件为,B的起始物质的量浓度为,各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 |
t2~t3 |
t3~t4 |
t4~t5 |
t5~t6 |
| K1 |
K2 |
K3 |
K4 |
K5 |
则K1=(保留两位小数),
K1、K2、K3、K4、K5之间的关系为(用“>”、“<”或“=”连接).
(3) t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式
。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为.
现有以下四种溶液;①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.请回答下列问题:
(1) ②④溶液中由水电离出来的c(H+)的关系是:②④(填“>”“<”或“=”).
(2) 将②③溶液等体积混合后,溶液的pH7 (填“>”“<”或“:”).,
(3)将①④溶液均稀释至原来的10倍后,它们的pH之和14(填“>”“<”或“=”).
(4)向300 mL溶液④中通入44.8 mL C02(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是 ( )
| A.c(Na+)+ c(H+)= c(OH—)+ c(HCO3—)+ 2c(CO32—) |
B.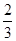 c(Na+)= c(HCO3—)+ c(CO32—)+ c(H2CO3) c(Na+)= c(HCO3—)+ c(CO32—)+ c(H2CO3) |
| C.c(Na+)> c(CO32—)> c(HCO3—)> c(OH—)> c(H+) |
| D.c(Na+)> c(HCO3—)> c(CO32—)> c(OH—)> c(H+) |
pH=12的NaOH溶液100ml,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加mL。
(2)如果加入pH=10的NaOH溶液,就加mL。
(3)如果加0.01mol/L的HC1,应加mL。
在一个固定体积的密闭容器中发生某反应,当改变其他反应条件,在I、II、III阶段,体系中各物质浓度随时间变化的曲线如下图所示: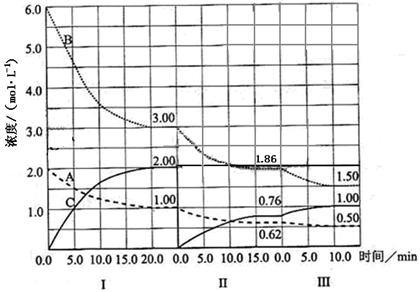
(1)该反应的化学方程式为(物质用图中的“A”、“B”、“C”表示),该反应在第I阶段的平衡常数为。
(2)第III阶段,从开始至平衡,用B表示的平均反应速率为;
(3)第I阶段,A的转化率为;第III阶段达平衡后,C的体积分数为;
(4)由第一次平衡到第二次平衡,平衡移动的方向是,采取的措施是;
(5)已知第Ⅱ阶段反应温度(T2)低于第III阶段反应温度(T3),则该反应的正反应
△H0(填“<”或“>”)