【化学—物质结构与性质】
已知a、b、x、y、z五种元素的原子序数依次增大,其中a原子的半径是所有原子中半径最小的,b原子中的电子有6种不同的运动状态,y原子的L层有2对成对电子,z元素的电负性是前四周期中最小的。
(1)x、y两种元素的第一电离能的大小为x y(填“>”、“<”或“=”),用原子结构的知识解释原因 ;
(2)固体物质M的化学式为x a 5,它的所有原子最外层都符合相应的稀有气体原子的最外电子层结构。则该化合物中a元素的化合价为 和 ;该化合物中x原子的杂化方式为 ;
(3)如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,z原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。现把C60 抽象成质点,该晶体的晶胞结构如图所示,若每个四面体空隙填入一个z元素的原子,则 z元素全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为 。
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
①CO(g)+H2O(g)  CO2(g)+H2(g)△H=-41 kJ/mol
CO2(g)+H2(g)△H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器编号 |
起始时各物质物质的量/mol |
达到平衡的时间/min |
达平衡时体系能量的变化/kJ |
||||
| CO |
H2O |
CO2 |
H2 |
||||
| ① |
1 |
4 |
0 |
0 |
t1 |
放出热量:32.8 kJ |
|
| ② |
2 |
8 |
0 |
0 |
t2 |
放出热量:Q |
|
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为%。
(3)计算容器②中反应的平衡常数K=。
(4)下列叙述正确的是 (填字母序号)。
A.平衡时,两容器中H2的体积分数相等
B.容器②中反应达平衡状态时,Q > 65.6 kJ
C.反应开始时,两容器中反应的化学反应速率相等
D.容器①中,化学反应速率为: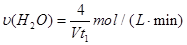
(5)已知:②2H2 (g) + O2 (g) = 2H2O (g)ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:。
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)。
(7)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图中所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。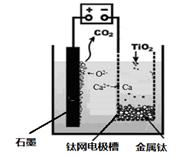
①写出阳极所发生反应的电极反应式:。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合反应式解释)。
甲是一种盐,由A、B、C、D、E五种短周期元素元素组成。甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀。
③取少量甲溶液于试管中逐滴滴入NaOH溶液,生成沉淀的质量与滴入NaOH溶液的体积关系如图所示;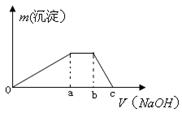
④取少量甲溶液于试管中,加入过量NaOH溶液并加热;
回答下列问题:
(1) D在周期表中的位置写出化合物AB3的电子式
(2)经测定甲晶体的摩尔质量为453 g/mol,其中阳离子和阴离子物质的量之比1:1,且1 mol 甲晶体中含有12 mol结晶水。则甲晶体的化学式为。
(3)实验③中根据图像得V(Oa):V(ab):V(bc)= 。
(4)实验④中离子方程式是。
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用下图A装置制备乙酸乙酯.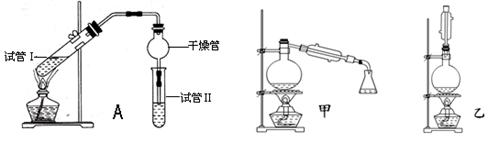
(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:
与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是.
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 |
试管Ⅰ中试剂 |
试管Ⅱ中试剂 |
有机层的厚度/cm |
| A |
2mL乙醇、1mL乙酸、 1mL18mol•L-1浓硫酸 |
饱和Na2CO3溶液 |
3.0 |
| B |
2mL乙醇、1mL乙酸 |
0.1 |
|
| C |
2mL乙醇、1mL乙酸、 3mL2mol•L-1H2SO4 |
0.6 |
|
| D |
2mL乙醇、1mL乙酸、盐酸 |
0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是mL和mol•L-1.
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
(3)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为.
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图.图中( )内为适当的试剂,【 】内为适当的分离方法.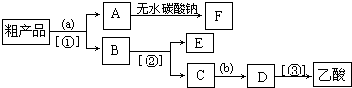
①试剂a是;分离方法②是,分离方法③是.分离方法①是分液,在具体操作中应充分振荡,然后静置,待分层后(填标号),
A.直接将乙酸乙酯从分液漏斗上口倒出
B.直接将乙酸乙酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸乙酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出
②在得到的A中加入无水碳酸钠粉末,振荡,目的是.
(5)为充分利用反应物,甲、乙两位同学分别设计了上面图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为最合理的是
石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平。请回答下列问题。
(1)下列物质中,不可以通过乙烯发生加成反应得到的是(填序号)。
| A.CH3CH3 | B.CH3CHCl2 | C.CH3CH2OH | D.CH3CH2Br |
(2)工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为 ,反应类型是。
(3)已知 2CH3CHO+O2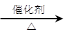 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。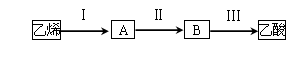
反应II的化学方程式为。
(4) 某有机物12g完全燃烧,生成7.2gH2O和8.96LCO2(标准状况下),0.5mol此有机物的质量为30g。则该有机物的分子式为又知此有机物不具有弱酸性,不能与金属钠反应,能与碱溶液反应,试写出其结构简式
某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表:
| 实验 序号 |
铁的质量/g |
铁的 形态 |
V(H2SO4) /mL |
c(H2SO4) /mol·L-1 |
反应前溶液 的温度/℃ |
金属完全消 失的时间/s |
| 1 |
0.10 |
片状 |
50 |
0.8 |
20 |
200 |
| 2 |
0.10 |
粉状 |
50 |
0.8 |
20 |
25 |
| 3 |
0.10 |
片状 |
50 |
1.0 |
20 |
125 |
| 4 |
0.10 |
片状 |
50 |
1.0 |
35 |
50 |
请分析上表信息,回答下列问题。
(1)实验1、2 表明 对反应速率有影响。
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号)。
(3)该探究实验中,影响反应速率的因素还有 ,体现该影响因素的实验有 (填实验序号)。
(4)进行实验3时,若将稀硫酸改为50 mL 2.0 mol·L-1 盐酸(其他条件不变),发现:放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是。(忽略温度对反应速率的影响)