正丙醇蒸气与空气混合通过热铜网,生成一种化合物,与该化合物互为同分异构体的是( )
A CH3CH2OCH3 B CH3 CHOH CH3
C 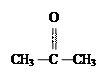 D CH3COOCH3
D CH3COOCH3
将NaOH溶液逐滴加入NH4HCO3溶液中,下列各示意图表示的混合溶液有关量的变化趋势,其中正确的是
常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列叙述正确的是 
| A.HA为弱酸,MOH为强碱 |
| B.pH=7时,HA与MOH恰好完全反应 |
| C.在N点,c(A-)=c(M+) + c(MOH) |
| D.在K点,c(M+)>c(A-)>c(OH-)>c(H+) |
在一密闭恒容容器中发生如下反应:aX(g)+bY(g) cZ(g)ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是
cZ(g)ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是
| A.升高温度,正反应速率增大,逆反应速率减小, 平衡常数增大 |
| B.若通入稀有气体平衡不移动,则a+b=c |
| C.若加入催化剂,反应速率改变,但平衡不移动 |
| D.若增加X的量,平衡正向移动,X的转化率增大 |
如下图所示,甲池的总反应式为:N2H4+O2=N2+2H2O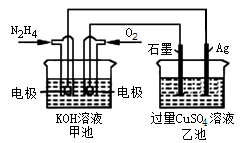
下列关于该电池工作时说法正确的是
| A.甲池中负极反应为:N2H4-4e-=N2+4H+ |
| B.甲池溶液pH不变,乙池溶液pH减小 |
| C.甲池中消耗2.24L O2,此时乙池中理论上最多产生12.8g固体 |
| D.反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度 |
常温下列各组离子在指定溶液中可能大量共存的是
| A.含有大量ClO-的溶液:Na+、OH-、I-、SO32- |
| B.澄清透明的溶液:Cu2+、Fe3+、NO3-、Cl- |
| C.使pH试纸变蓝的溶液:NH4+、K+、S2-、CO32- |
D.c(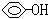 )=0.1mol/L的溶液:Na+、Cl-、CO32-、NO3- )=0.1mol/L的溶液:Na+、Cl-、CO32-、NO3- |