下图是元素周期表的一部分,表 中的①~⑩中元素,用元素符号或化学式填空回答:
中的①~⑩中元素,用元素符号或化学式填空回答:
 族 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
|
|
|
① |
|
|
② |
|
| 三 |
③ |
④ |
⑤ |
⑥ |
|
|
⑦ |
⑧ |
| 四 |
⑨ |
⑩ |
|
|
|
|
|
|
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为 。
(2)用电子式表示②与④形成化合物的 过程 。
过程 。
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。
(4)写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:
。
甲同学设计了如下图所示的原电池,电解质溶液为FeCl2溶液,但灯泡不亮。 乙、丙同学对甲的设计分别做了改进后,灯泡亮了。根据上述素材,回答以下问题:
乙、丙同学对甲的设计分别做了改进后,灯泡亮了。根据上述素材,回答以下问题: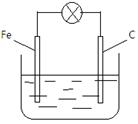
⑴乙同学换了一个电极 ,如果他的铁片更换,你认为可以换成(化学式)
,如果他的铁片更换,你认为可以换成(化学式)
⑵丙同学把电解质溶液换成了FeCl3溶液,写出电极方程式,
负极:正极:
(5分)有下列几种物质:①Ne ②NH4Cl ③NaOH ④Cl2 ⑤KNO3⑥CO2 ⑦H202 ⑧Na2O2
属于共价化合物得是(填序号,下同),只存在极性键的是,既存在极性键又存在非极性键的是,既存在极性键又存在离子键的是,既存在离子键又存在非极性键的是。
常温下,有pH值为12的NaOH溶液100 ml,欲将其pH值变为11,采取下列三种措施(忽略混合过程中溶液体积的变化),请回答有关问题:
(1)若加水,应加入ml。
(2)若用pH=10的NaOH溶液,应加入ml。
(3)若用pH=2的盐酸,应加入ml。
(6分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学 化学知识回答下列问题:
化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序___。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)____________________________________。
(3)浓度为0.1mol/L的(NH4)2Fe(SO4)2溶液与(1)相比c(NH4+)中的大(填化学式)
(10分)如表是不同温度下水的离子积数据:试回答以下问题:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
KW |
1×10-12 |
(1)若25<t1<t2,则KW___1×10-14(填“>”、“<”或“=”),作出此判断的理由是__。
(2)25℃下,某Na2SO4溶液中c(SO)=5×10-4mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+):c(OH-)=__________。
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH =2,则V1:V2=_______。此溶液中各种离子的浓度由大到小的排列顺序是___________。