根据部分短周期元素的原子半径及主要化合价信息,判断以下叙述正确的是
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
| 主要化合价 |
+2 |
+3 |
+2 |
+6、—2 |
—2 |
A.氢化物的沸点为H2T<H2R B.金属性强弱:L<Q
C.M与T形成的化合物的化学式是Al2O3 D.L2+与R2-的核外电子数相等
反应CO(g)+H2O(g) 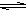 CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO |
H2O |
CO2 |
H2 |
| 0.5 mol |
8.5 mol |
2.0 mol |
2.0 mol |
此时反应中正、逆反应速率的关系式是
A.v(正)>v(逆)B.v(正)<v(逆)
C.v(正)=v(逆) D.无法判断
下列各组混合物中,总质量一定时,二者以不同比例混合,完全燃烧时,生成CO2的质量不一定的是
| A.乙炔、苯乙烯 | B.甲烷、辛醛 |
| C.甲苯、对二甲苯 | D.乙烯、庚烯 |
现有1.0 mol/L的NaOH溶液0.1L,若通入标准状况下体积为2.24L 的SO2气体,使其充分反应后,则所得溶液中各粒子浓度大小关系正确的是
| A.c(Na+)+c(H+) = c(HSO3―) +c(SO32―) + c( OH―) |
| B.c(Na+) = c(H2SO3) + c(HSO3―) + c ( H+) |
| C.c(SO32―) + c( OH―) = c(H+) + c(H2SO3) |
| D.c(Na+)>c(HSO3―)>c( OH―)>c(H2SO3)>c(SO32―)>c(H+) |
把固体Ca(OH)2放入蒸馏水中达到溶解平衡后:Ca(OH)2(s) Ca2+ (aq)+ 2OH-(aq),下列说法中正确的是
Ca2+ (aq)+ 2OH-(aq),下列说法中正确的是
| A.给溶液加热,溶液中的Ca2+浓度一定增大 |
| B.恒温条件下向溶液中加入少量CaO,溶液的pH升高 |
| C.向溶液中加入少量CH3COONa晶体,则Ca(OH)2固体的质量增多 |
| D.向溶液中加入少量冰醋酸,溶液中的OH-浓度增大 |
与pH类似,我们定义pOH=-lgc(OH-),下列溶液,一定呈中性的是
| A.c(H+)=1×10-7mol·L-1的溶液 | B.水电离的H+和OH-浓度相等的溶液 |
| C.pH+pOH=14的溶液 | D.pH=pOH的溶液 |