11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中,被氧化的P原子与被还原的P原子个数比是
| A.6:5 | B.5:6 | C.11:5 | D.11:6 |
【原创】下列化学用语正确的是
| A.丙烯的结构简式:CH2CHCH3 | B.(CH3)2CHOH的名称为2–丙醇 |
C.HF的电子式: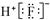 |
D.四氯化碳分子比例模型: |
900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: 。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| 时间/min |
0 |
10 |
20 |
30 |
40 |
| n(乙苯)/mol |
0.40 |
0.30 |
0.24 |
n2 |
n3 |
| n(苯乙烯)/mol |
0.00 |
0.10 |
n1 |
0.20 |
0.20 |
下列说法正确的是
A.反应在前20 min的平均速率为v(H2)=0.004mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol·L-1,则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆)
常温下,对pH=10的NaHCO3溶液中,各微粒的物质的量浓度分析正确的是
| A.c(CO32—)>c(H2CO3) |
| B.c(Na+)>c(HCO3—)>c(OH―)>c(H+) |
| C.c(Na+)+c(H+)=c(HCO3—)+c(CO32—)+c(OH―) |
| D.c(Na+)=c(HCO3—)+c(CO32—)+c(H2CO3) |
【改编】化学与社会、生活密切相关。对下列现象或事实的解释正确的是
| 选项 |
现象或事实 |
解释 |
| A. |
铝制餐具不宜长时间存放酸性、碱性的食物 |
铝能与食物中的酸、碱反应 |
| B. |
伤口消毒常应用75%的酒精而不是95% |
75%的酒精其氧化性要强于95% |
| C. |
养金鱼用的自来水一般先在阳光下晒一段时间 |
能增加水中氧气的含量 |
| D. |
洁厕灵不能与“84”消毒液混用 |
两种溶液混合产生的有毒气体——氯气 |
一种瑞香素的衍生物的结构简式如图,下列有关该有机物性质的说法正确的是
| A.能与FeCl3溶液发生显色反应 |
| B.1mol该有机物最多可与3molH2加成 |
| C.1mol该有机物最多可与含5molNaOH的溶液反应 |
| D.1mol该有机物与足量NaHCO3溶液反应可放出3molCO2 |