今年5月,我市各校进行了化学实验操作考查,一些同学用下图所示的仪器和装置进行常见气体的制取和性质实验。请回答下列问题:根据下列实验装置图回答:
(1)写出图中标有编号仪器的名称:
a ____________; b _______________。
(2)小红同学用石灰石、稀盐酸制取并收集一瓶二氧化碳,应选用图甲中的________和_________装置(填装置对应的字母),该反应的符号表达式是 ________________ 收集二氧化碳后,小红将燃着的木条放在集气瓶口,若气体收集满,可观察到的现象是_______________________________。
(3)A、B两套装置均可用于实验室制取氧气。若采用 (选填A或B)装置,产生氧气的符号表达式为 若选装置E收集氧气,则收集方法是根据氧气 的性质而确定的。
(4)实验室用氢氧化钙固体和氯化铵固体加热制取氨气,氨气有刺激性气味,易溶于水,密度比空气小;请选择图中的 和 装置来制取收集该气体
小明非常喜欢学习化学,并常用学过的化学知识解释一些现象.请你试着和小明一起体会活用化学知识的快乐吧!
(1)上午:小明参加学校运动会短跑项目时,对“发令枪”产生了浓厚的兴趣.通过上网搜索后了解到:“发令枪”里的火药成分为氯酸钾,二氧化锰和红磷.当扣动扳机时,①撞针撞击火药,产生热量使氯酸钾分解产生氧气,②并引燃红磷产生白烟.试分别写这两步反应的文字表达式。
① __________________________;此反应的基本类型是__________________。
②___________________________。
(2)中午:小明放学一进门就看到妈妈在煤气灶上忙活着做饭,通过查阅资料,小明知道煤气的主要成分是CO,如图是CO与CO2反应的微观示意图,反应前后没有发生变化的粒子是()
| A.①② | B.②③ | C.③④ | D.④⑤ |

(3)下午:小明看到妈妈向洗衣服的水中加入肥皂水,搅拌后由絮状沉淀物,因此他认为本地的水为__________(填“硬水”或“软水”).他还了解到长期饮用这种硬度高的水对人体健康不利.所以人们才在日常生活中采用____________的方法来软化水’.
请根据要求用化学符号填空
(1)3个钠原子__________;
(2)4个氧离子__________;
(3)保持氢气化学性质的最小粒子___________;
(4)写出高锰酸钾的化学式并标出锰元素的化合价______________.
给下列物质分类:a.铁 b.海水 c.蒸馏水 d.四氯化碳 e.液态氮 f.臭氧 g.加热高锰酸钾后剩下的固体 h.二氧化氮
(1)纯净物______________;(2)混合物______________;(3)单质_____________
(4)化合物______________;(5)氧化物______________.(以上全填写序号)
下列叙述分子某个特性的A~E中,选择适当序号填空:
| A.分子间有间隔 | B.受热分子运动速度加快,间隔变大 |
| C.分子有质量,但很小 | D.分子不断运动 |
E、同种分子性质相同
(1)10ml水和10ml酒精混合后总体积小于20ml 。
(2)很远的地方可闻到花香 。
(3)碘的蒸气、碘的固体颗粒都能使馒头变蓝 。
(4)夏天自行车胎易爆 。
(5)一滴水约有1.67×1021个水分子,1滴水的质量约为5.01×10-5kg 。
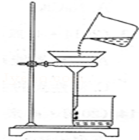
小红同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会后,采用如图所示装置将上层液体进行过滤,请问:
(1)加明矾的作用是 。
(2)图中还缺少一种仪器是 ,其作用是 。
(3)过滤后发现滤液仍然浑浊,可能的原因 (写其中一条)。
(4)改进装置后过滤,得到了澄清透明的水,她兴奋的宣布:我终于制得了纯水!对此,你是否同意她的看法? (填“同意”或“不同意”),理由是 。