根据图示填空
(1)化合物A中含氧官能团的名称是 。
(2)1mol A与2 mol H2反应生成1 mol E,其反应方程式是
___________________________________________________。
(3)B在酸性条件下与Br2反应得到D,D的结构简式是  。写出D与NaOH溶液反应的化学方程式_________________________________________。
。写出D与NaOH溶液反应的化学方程式_________________________________________。
(4)F的结构简式是 。
某些化学反应可用下式表示:A + B → C+ D + H2O。请回答下列问题(反应可以是固体之间的反应,也可以是在水溶液中进行的反应):
(1)若C是一种碱性气体,常用作制冷剂。则C为(填化学式下同)。实验室制取C气体的化学方程式为。
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊且C能使溴水褪色。则A为。写出C与溴水反应的化学方程式。
(3)若A为紫红色金属,D为红棕色气体。则A为。D与水反应的化学方程式为。
(1)元素A是第三周期ⅦA族元素,A元素与另两种非金属元素可组成离子化合物甲。写出甲的化学式________。
(2)在所有的气态氢化物中,元素B的氢化物最稳定,写出元素B在周期表中的位置_________。
(3)金属元素C形成的某化合物的溶液常用于检验CO2,则元素C的简单离子与元素A的简单离子的半径大小关系是________(用离子符号表示),元素D的原子序数比元素C小8,写出元素D的单质在CO2中燃烧的化学方程式________。
(4)元素E是第三周期中简单离子半径最小的元素,元素F是第三周期中原子半径最大的元素,写出元素E的单质与元素F的最高价氧化物对应水化物反应的的离子方程式________________。
用学过的知识回答下列问题
(1)用一种试剂将下列各组物质鉴别开.
① 和
和 :
:
② ,CCl4和乙醇:
,CCl4和乙醇:
(2)二甲苯苯环上的一溴代物有6种同分异构体,这些一溴代物与生成它的对应二甲苯的熔点分别列表如下:
| 一溴代二甲苯 |
234°C |
206°C |
213.8°C |
204°C |
214.5°C |
205°C |
| 对应二甲苯 |
13°C |
-54°C |
-27°C |
-54°C |
-27°C |
-54°C |
由表内数据可以推断:
①熔点为234°C的一溴代二甲苯的结构简式为,
②熔点为-54°C的二甲苯的名称为。
(3)有机物X的键线式为: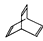 ,芳香烃Y是X的同分异构体,Y能使溴水褪色。
,芳香烃Y是X的同分异构体,Y能使溴水褪色。
①Y的结构简式为:。
②Y可以用来合成一种聚合物---泡沫塑料,请写出该聚合物的结构简式_。
丙烯醇( )是一种重要的有机合成原料。
)是一种重要的有机合成原料。
(1)丙烯醇中含有的官能团的化学符号是
(2)0.3mol丙烯醇与11.5g金属钠反应,能生成标准状况下的氢气_________ L。
(3)写出丙烯醇与溴水反应的化学方程式____________________________
(4)丙烯醇与CH3 CO 18OH发生酯化反应的化方程式为:_______________________
酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式为________
(5)设计方案用丙烯醇合成丙烯,在下面空格中写出方案中涉及的所有化学反应方程式:
按要求填空:
(1)写出下列物质的分子式:含6个碳原子的链状单烯烃
(2)在戊烷的各种同分异构体中,一氯代物种类最多的键线式是
(3)用系统命名法命名 :
:
(4)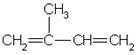 与等物质的量的Br2反应,生成的产物有___________种,
与等物质的量的Br2反应,生成的产物有___________种,
用系统命名法进行命名,它的名称是
(5)某化合物的分子式为C5H11Cl,分析数据表明:分子中有两个—CH3、两个—CH2—、一个 和一个—Cl。它的可能的结构有种
和一个—Cl。它的可能的结构有种