亚硝酸钠( NaNO2)外观酷似食盐,但它是一种有毒的物质。误食亚硝酸钠会使人体血液中的Fe2+转化为Fe3+而引起中毒,服用维生素C可使Fe3+转化为Fe2+,从而达到解毒的目的。转化过程可表示为:Fe2+
NaNO2)外观酷似食盐,但它是一种有毒的物质。误食亚硝酸钠会使人体血液中的Fe2+转化为Fe3+而引起中毒,服用维生素C可使Fe3+转化为Fe2+,从而达到解毒的目的。转化过程可表示为:Fe2+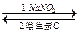 Fe3+
Fe3+
(1)转化1中,氧化剂是 ,还原剂是 。
(2)转化2中,Fe3+作 剂,维生素C表现 性。
(10分)维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行滴定。该反应的化学方程式如下:
C6H8O6+I2===C6H6O6+2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下:
取10 mL 6 mol·L-1CH3COOH溶液,加入100 mL蒸馏水,将溶液加热煮沸后冷却。精确称取0.2000 g样品,溶解于上述冷却的溶液中,加入1 mL指示剂,立即用浓度为0.05000 mol·L-1的I2溶液进行滴定到终点,消耗21.00 mL I2溶液。
(1)实验中的指示剂是_____________。
(2)加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用。煮沸的目的是________________;冷却的目的是__________________。
(3)计算样品中维生素C的质量分数(要求列式,且式中各物理量带单位)。
(8分)有机物A与乙酸无论以何种比例混合,只要总质量一定,完全燃烧后产生的水的质量也一定,试回答:
(1)若A与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则A的结构简式为 。
(2)若A由四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则A的结构简式为 。
(3)若A分子中C、H元素质量分数之和为86.67%,其余为O,且A的相对分子质量小于200,则A的分子式为 。如果A分子中每个碳原子都达到饱和,且能与金属钠反应产生氢气,则A的结构简式为 。
(12分)分子式为C3H6O3的物质有多种同分异构体,请写出符合下列要求的各种同分异构体的结构简式(不考虑同一碳原子上连两个羟基),并回答相关问题:
(1)甲分子中没有甲基,且1 mol甲与足量金属Na反应生成1 mol H2,还能与NaHCO3溶液反应,则甲的结构简式为 ,该物质 溶于水(填“难”或“易”), 原因是 ,该物质的熔点明显高于相对分子质量相接近的烃类化合物的熔点,原因是 。
(2)乙分子中碳与氧分别有两种化学环境,氢的化学环境相同,且乙与金属Na不反应,则乙结构简式为 ,该物质属于 类化合物(填“醇”、“醛”、“羧酸”或“酯”),它的液体密度应比水 。
下图所示为某些有机物之间的相互转化关系,其中A、B属于芳香族化合物,且B不能与FeCl3溶液发生显色反应,H是衡量一个国家石油化工发展水平标志的物质。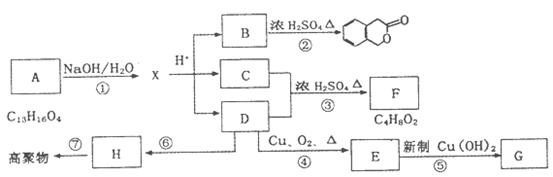
请回答下列问题:
(1)写出下列化合物的结构简式;
G __________________________ B__________________________
(2)写出下列反应类型:①_____________⑥______________
(3)写出反应①、④的化学方程式:
①_________________________________________________________________
④_________________________________________________________________
(4)符合下列3个条件的B的同分异构体的数目有________个。
①含有邻二取代苯环结构②与B有相同官能团③不与FeCl3溶液发生显色反应写出其中任意一个同分异构体的结构简式 __________________________。
某烃A的相对分子质量为84。回答下列问题:
(1)物质的量相同,下列物质充分燃烧与A消耗氧气的量不相等的是(填序号)_____________ 。
| A.C7H12O2 | B.C6H14 | C.C6H14O | D.C7H14O3 |
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。则A的结构简式为______________。
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,则A的名称为_____________。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为_____________.