无色溶液X由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种离子组成,取溶液进行如下连续实验:
(1)气体A的成分是(填化学式,下同) ,气体B的成分是:
(2)溶液中一定存在的离子有: 。
可能存在的离子有: 。
(12分) 钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。下图是以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料生产钛白粉并获得副产品FeSO4·7H2O的工艺流程图。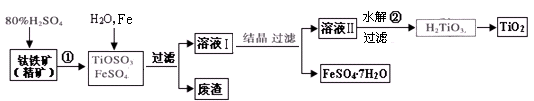
(1)钛铁矿与硫酸发生反应①的化学方程式为;在TiOSO4和FeSO4溶液中加入Fe的目的是。
(2)溶液Ⅱ中TiOSO4在加热条件下发生水解反应②的离子方程式为;可回收利用的物质是。
(3)为测定溶液Ⅱ中TiOSO4的含量,首先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用(填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,当溶液出现红色达到滴定终点,用去了30.00mL FeC13溶液。待测钛液中TiOSO4的物质的量浓度是。
斑螯素能抑制肝癌的发展,去掉斑螯素中的两个甲基制得的化合物——去甲基斑螯素仍具有相应的疗效,其合成路线如下:
已知:① 2HCHO+NaOH→ CH3OH+HCOONa
②  (Diels-Alder 反应)
(Diels-Alder 反应)
③当每个1,3-丁二烯分子与一分子氯气发生加成反应时,有两种产物: CH2ClCH=CHCH2Cl;CH2ClCHClCH=CH2。
请回答下列问题:
(1)物质A中含有的含氧官能团名称分别为;第①步反应中还生成另一产物,此产物的结构简式为。
(2)写出H的结构简式;第⑤步反应的反应类型是。
(3)去甲基斑螯素与X互为同分异构体。X能与FeCl3溶液发生显色反应,能与Na2CO3溶液反应生成气体,且其核磁共振氢谱有4个吸收峰。写出满足上述条件的X的一种结构简式。
(4)结合题中有关信息,写出由 制备丁烯二酸酐
制备丁烯二酸酐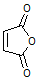 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
。
(12分) 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下: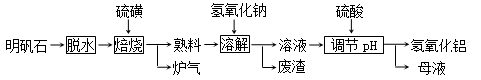
回答下列问题:
(1)“焙烧”过程中发生的反应为2Al2(SO4)3+3S  2Al 2O3+9SO2,其中氧化剂为。
2Al 2O3+9SO2,其中氧化剂为。
(2)“溶解”时反应的离子方程式为。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是
。
(4)调节pH时使用的是质量浓度(单位体积溶液所含溶质的质量)为882 g/L 的H2SO4 ,配制1L该溶液,需用量筒量取质量分数为98﹪的硫酸(密度是1.8g/cm3)
mL
(5)“废渣”、“母液”中可回收的物质分别是。
下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH2K2CO3+6H2O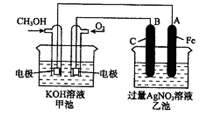
(1)请回答图中甲、乙两池的名称。甲电池是装置,乙池是装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是,B(石墨)电极的名称是。
(3)写出电极反应式:
通入O2的电极的电极反应式是。
A(Fe)电极的电极反应式为,
(4)乙池中反应的化学方程式为。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2mL(标准状况下)
一个完整的氧化还原反应方程式可以拆分,写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu====2Fe2++Cu2+,可以写成:氧化反应 Cu—2e—====Cu2+;还原反应 2Fe3++2e—====2Fe2+(或Fe3++e—====Fe2+)。
(1)根据以上信息将反应3NO2+H2O===2H++2NO3—+NO拆分成两个“半反应式”:
氧化反应式;还原反应式。
(2)已知某一反应的“半反应式”为CH4+10OH——8e—====CO32—+7H2O;O2+2H2O+4e—
====4OH—,则总反应式为。