某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)  2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大
B. 平衡不发生移动
C. 平衡向逆反应方向移动
D. 物质C的质量分数增大
下列有关化学平衡移动叙述中正确的是:
A.可逆反应:Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硝酸,溶液变橙色,氢离子浓度随时间变化曲线如上图一 2CrO42-(黄色)+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硝酸,溶液变橙色,氢离子浓度随时间变化曲线如上图一 |
B.可逆反应Co(H2O)62+(粉红色)+4Cl- CoCl42- (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如上图二 CoCl42- (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如上图二 |
C.可逆反应:2NO2 N2O4达平衡状态呈红棕色,加压红棕色变深,NO2物质的量随时间变化曲线如上图三 N2O4达平衡状态呈红棕色,加压红棕色变深,NO2物质的量随时间变化曲线如上图三 |
D.可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如上图四 2NH3(g) ΔH<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如上图四 |
有如下实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是:
| A.滤液b中不含有Ag+ |
B.浊液a中存在沉淀溶解平衡:AgCl(g) 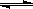 Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
| C.③中颜色变化说明AgCl转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
下列比较正确的是:
| A.电镀铜和电解精炼铜:两极质量变化相同均为△m(阴极)增=△m(阳极)减 |
| B.电化学腐蚀和化学腐蚀:均发生了氧化还原反应且均伴随有电流产生 |
| C.氯碱工业和工业冶炼钠:所用原料、反应条件均相同 |
| D.牺牲阳极的阴极保护法和外加电流的阴极保护法:均有电子流向被保护设备并在其上发生还原反应 |
25℃时,pH=3的盐酸aL分别与下列三种溶液充分混合后,溶液均呈中性:①c(NH3·H2O)=10-3mol·L-1的氨水bL,②c(OH-)=10-3mol·L-1的氨水cL,③c(OH-)=10-3mol·L-1的Ba(OH)2溶液dL。试判断a、b、c、d的数量大小关系为:
| A.a=b>c>d | B.b>a=d>c | C.b>a>d>c | D.c>a=d>b |
现用pH=3的CH3COOH溶液和pH=11的NaOH溶液各V mL,进行中和滴定,当滴定到pH=7时,锥形瓶内溶液的体积为(滴定前后溶液未稀释、总体积不变):
| A.等于2V mL | B.小于2V mL | C.大于2V mL | D.无法确定 |