化合物A是一种热稳定性较差的无水的弱 酸钠盐。用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果列于下表:利用上述信息和下表中数据,通过作图,推断化合物A的化学式,并给出主要计算过程。
酸钠盐。用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果列于下表:利用上述信息和下表中数据,通过作图,推断化合物A的化学式,并给出主要计算过程。
| 样品中A的质量分数/% |
样品的质量损失/% |
| 20 |
7.4 |
| 50 |
18.5 |
| 70 |
25.8 |
| 90 |
33.3 |
NH3是一种重要的化工产品。
(1)根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu)(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar(Cu)。为此,提供的实验仪器及试剂如下(根据实验需要,装置可重复选择,加入的NH4 Cl与Ca(OH)2的量足以产生使CuO完全还原为N2的氨气)。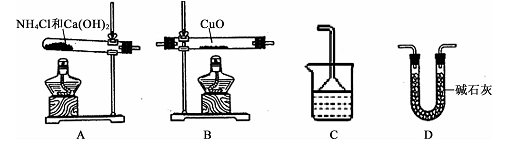
请回答下列问题:
①氨气还原炽热氧化铜的化学方程式为_______________;
②从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的字母表示)A→ ;
③在本实验中,若测得m( CuO) =ag,m(H2O)="b" g,则Ar(Cu)= ;
④在本实验中,使测定结果Ar(Cu)偏大的是 (填字母);
| A.CuO未完全起反应 | B.CuO不干燥 |
| C.CuO中混有不反应的杂质 | D.NH4 Cl与Ca(OH)2混合物不干燥 |
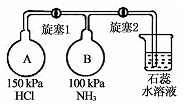
(2)按右图装置进行NH3性质实验。
①先打开旋塞1,B瓶中的现象是 原因是
②稳定后,关闭旋塞1,再打开旋塞2,B瓶中的现象是 。
I.化工工业中常用乙苯脱氢的方法制备苯乙烯。
已知某温度下:
反应①:CO2 (g) +H2 (g)→CO(g) + H2O(g),ΔH =" +41.2" kJ/mol;
反应②: 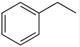 (g)→
(g)→ (g)+H2(g),ΔH=" +117.6" kJ/mol;
(g)+H2(g),ΔH=" +117.6" kJ/mol;
①②的化学反应平衡常数分别为K1、K2,
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 ,该反应的化学平衡常数K= (用K1、K2表示)
(2)对于反应①,恒温恒容条件下,向密闭容器中加入2molCO2和2molH2,当反应达到平衡后,以下说法正确的是
| A.因为该反应是吸热反应,所以升高温度,正反应速率增大,逆反应速率减小; |
| B.若再加入1molCO2、1mol H2,平衡不移动; |
| C.若再加入CO2则平衡向正反应方向移动,CO的体积分数减小; |
| D.若充入He,平衡不移动,反应物和产物的浓度都不变; |
(3)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2;请在下图中画出t1之后的正逆反应曲线,并作出标注。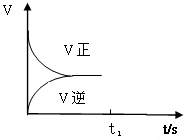
II.一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。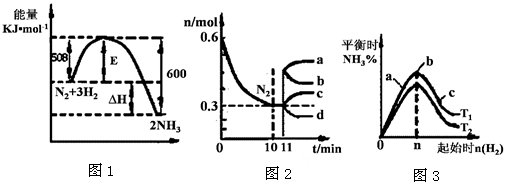
(4)升高温度,该反应的平衡常数 (填“增大”或“减小”或“不变”)。
(5)由图2信息,计算10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
(6)图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
下图是一个化学过程的示意图。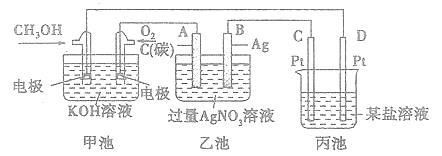
(1)图中甲池中OH-移向 极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为 极(填“A”或"B”),并写出此电极的反应式:____ 。
(4)乙池中总反应的离子方程式:____ 。
(5)当乙池中B(Ag)极的质量增加5.4g时,乙池的pH是 (若此时乙池中溶液的体积为500mL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是 (填序号)。
| A.MgSO4 | B.CuSO4 | C.AgNO3 | D.AlCl3 |
铁是最常见的金属材料.铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物.
(1)基态Fe3+的M层电子排布式为 ;
(2)尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
(3)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= . Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型).
(4)常温条件下,铁的晶体采用如图所示的堆积方式.则这种堆积模型的配位数为 ,如果铁的原子半径为a cm,阿伏加德常数的值为NA,则此种铁单质的密度表达式为 g/cm3.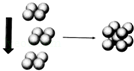
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害.某化学兴趣小组拟采用如图1处理方法回收废电池中的各种资源.
(1)填充物用60℃温水溶解,目的是 .
(2)操作A的名称为 .
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示).铜帽溶解完全后,可采用 方法除去溶液中过量的H2O2.
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 .
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O.
①当1mol MnO2参加反应时,共有 mol电子发生转移.
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式: .
(6)锌锰干电池所含的汞可用KMnO4溶液吸收.在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如图2所示:
根据图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率 .
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强.