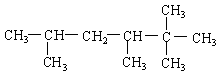分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物,某实验室的科技人员设计了下列合成路线:
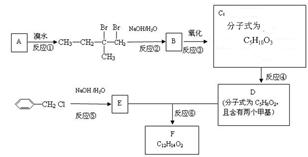
试回答下列问题:
|
(1)按系统命名法给A物质命名 ;
(2)C物质的官能团名称______;E物质的结构简式___________;按要求写出下列方程式
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式是:
(2)已知在25℃、101kPa时,CO的燃烧热为283kJ/mol,相同条件下,若2molCH4完全燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6.3倍,CH4完全燃烧反应的热化学方程式是:
(3)Al(OH)3的电离反应方程式:
(4)H2S的电离反应方程式:
(5)NaHSO4溶于水的电离方程式
某河道两旁有甲、乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO 六种离子。
六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、________、________。
(2)乙厂的废水中含有另外三种离子。如果加一定量________(选填“活性炭”“铁粉”),可以回收其中的________(填写金属元素符号)。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的________(填写离子符号)转化为沉淀。经过滤后的废水主要含________,可用来浇灌农田。
A、B、C、D、E为易溶化合物,其离子组成为
| 阳离子 |
Fe3+、Ba2+、Al3+、Na+、Ag+ |
| 阴离子 |
NO3—、OH—、SO42—、Cl—、CO32— |
在各化合物中离子不重复,分别取其溶液进行实验,结果如下:
①在A溶液中逐滴加入氨水,有白色沉淀生成,继续加氨水至过量,沉淀消失;
②用pH试纸测得B和C溶液显碱性,0.1mol/L的C溶液pH小于13;
③在D溶液中加入铁粉,溶液质量增加;
④在E溶液中加入过量B,没有沉淀产生。
完成下列填空:
(1)A的化学式为;
(2)③反应的离子方程式为;
(3)检验D溶液中阴离子的的方法是;
(4)E的的化学式为,将E蒸干、灼热至质量不再改变,最后所得物质是(填化学式)。
(本题共8分)一个有机物的分子量为70,红外光谱表征到碳碳双键和C=O的存在,核磁共振氢谱如下图: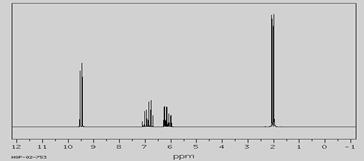
参考结构式,分析核磁谱图,回答下列问题:
分子中共有种化学环境不同的氢原子;谱线最高者表示有个环境相同氢原子,谱线最低者表示有个环境相同氢原子,结构式中的Et表示烷烃基,从什么图谱中可以推断结构式中的这个烷烃基是。
写出该有机物的可能的结构简式。
写出下列各烃的名称(8分,采用系统命名法)
(1)(CH3)2CH(CH2)2CH(C2H5)(CH2)2CH3(2)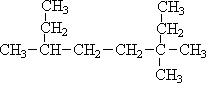
(3)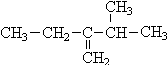 (4)
(4)