已知A为酸式盐,B为某二价主族金属元素的化合物,常温常压下C、D、F、G、I均呈气态。等物质的量A、B与少量的水充分混合能恰好完全反应。图中反应条件(除高温外)均已略去。请回答下列问题:
(1)写出B的电子式 ,
(2)写出A与B反应的化学方程式 。
(3)如对气体 G进行加压操作,产生的现象是 。
G进行加压操作,产生的现象是 。
(4)写出下列反应的离子方程式:
①在A溶液中加入M 。
②向A溶液中加入过量NaOH 溶液,并加热 。
溶液,并加热 。
25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白;
(1)a值可否等于3(填“可”或“否”)_________,其理由是___________________;
(2)a值可否等于5(填“可”或“否”)________,其理由是____________________;
(3)a的取值范围是_______________________________________。
(10分)某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
(1)该反应的化学方程式为______.
(2)反应开始至2min,用X表示的平均反应速率为______ mol·L-1·min-1;
平衡时,Y的转化率为______,
平衡时,Z的浓度为______ mol·L-1。
(3)下列叙述能说明上述反应达到平衡状态的是______(填选项、多选)
| A.X、Y、Z的物质的量之比为3:1:2 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗3mol X,同时生成2mol Z |
| D.混合气体的总质量不随时间的变化而变化 |
E.混合气体的总物质的量不随时间的变化而变化.
实验题:将V1 mL 1.0 mol·L-1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。请按要求填空:
(1)该实验表明此反应(填吸收、释放)能量,即:能可以转化为能,通过图示分析可以得出:做该实验时,环境温度(填高于、低于、等于)22 ℃;
(2)根据图示计算该NaOH溶液的浓度约是mol·L-1
(3)如图所示,在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:①烧碱固体 ②浓硫酸 ③硝酸铵固体 ④NaCl固体,其中能使a端液面高于b端液面的是_________(填序号)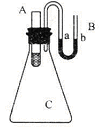
根据下面的描述,按照要求回答下列问题
(1)画出H2O2的电子式:__________
(2)请画出HClO的电子式:__________
(3)用电子式表示出离子化合物MgCl2的形成过程__________
(4)在短周期元素中,由三种非金属元素组成的既有离子键又有共价键,且阴阳离子含电子总数相等的物质,其化学式是__________,画出电子式_________
(5)某学生在一次探究“制取氢气最适宜的金属”的实验时,测得镁在与稀硫酸反应,10 s末硫酸的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸镁的平均反应速率是__________mol·L-1s-1。
根据元素周期表1~18号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有________种,金属性最强的元素与氧气反应生成的化合物有___________(填两种化合物的化学式)。
(2)属于稀有气体的是___________(填元素符号,下同)。
(3)形成化合物种类最多的两种元素是__________________。
(4)第三周期中,原子半径最大的是(稀有气体除外)______________。
(5)推测Si、N最简单氢化物的稳定性_______>_________(用化学式表示)。