有甲、乙两种物质: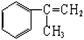
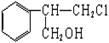
甲 乙
(1)乙中含有的官能团的名称为____________________(不包括苯环)。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):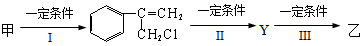
其中反应I的反应类型是___________,反应II的条件是_______________,反应III的化学方程式为___________________________________(不需注明反应条件)。
(3)下列物质不能与乙反应的是 (选填序号)。
a.金属钠 b.溴水 c.碳酸钠溶液 d.氢氧化钠溶液
(4)乙有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式 。
a.苯环上的一氯代物有两种 b.遇FeCl3溶液显示紫色
(8分)用结构简式填写下列空白:
(1)2,3-二甲基-4-乙基已烷______________________
(2)支链只有一个乙基且式量最小的烷烃______________________
(3)含有一个手性碳原子且式量最小的的单烯烃的结构简式是______________________
(4)若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为:
____________________________________
(8分)用系统命名法给下 列物质命名:
列物质命名:
(1) CH3CH(C2H5)CH(CH3)2______________________
(2) 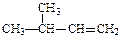 ______________________
______________________
(3) 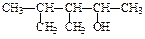 ______________________
______________________
(4) 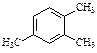 ______________________
______________________
(6分)写出下列物质的分子式:
(1)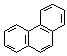 ______________________
______________________
(2)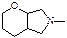 ______________________
______________________
(3)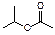 ______________________
______________________
有机物A的相对分子质量小于150,其中含氧的质量分数为23.5%,完全燃烧只生成二氧化碳和水。有机物之间的相互转化如图(部分反应条件略)。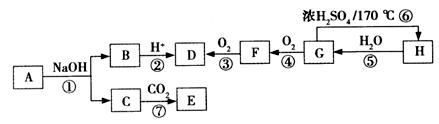
请回答下列问题:
(1)H和F中含有的官能团的名称分别为:H中______________;F中________________。
(2)有机物E的结构简式为_______________________________。
(3)有机物G能发生的反应类型有____________________(填字母)。
A.取代反应 B.加成反应 C.消去反应 D.加聚反应 E.氧化反应
(4)以M表示有机物的摩尔质量,则下列关系正确的是______________(填字母)。
A.M(A) =" M(B)" + M(C) B.M(D) =" M(G)" + 14
C.2M(F) + 18 =" M(D)" + M(G) D.M(D) > M(F) > M(G) > M(H)
(5)简述检验有机物F中的官能团的实验方法_______________________________
__________________________________________________________________________________________________________________________________________________。
(6)有机物A的一种同分异构体X,能发生银镜反应,且含有与E相同的官能团。则X的同分异构体有_________种。
(7)写出反应①的化学方程式:
_____________________________________________________________________;
写出反应⑦的化学方程式: _____________________________________________。
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题:
(1)E、F气态氢化物的稳定性为____________ > ______________(用化学式表示)。
(2)E与F可形成E2F2的化合物,其电子式为_________ ____________,其晶体类型为________________。
____________,其晶体类型为________________。
(3)C、D形成的一种化合物能与D、E形成的化合物在溶液中发生氧化还原反应,其离子方程式为:
_______________________________________________________________________。
(4)A、C、E三种元素形成的一种常见化合物H,其浓溶液在加热条件下可与a g铜反应,则被还原的H的物质的量为___________________。
(5)E的一种常见氧化物为大气污染物,实验室可用足量D的最高价氧化物的水化物来吸收,则吸收生成的盐溶液中离子浓度大小关系为:
_____________________________________________________________________。
(6)b g D单质在纯净的C单质中燃烧放出Q kJ热量,则相关的热化学方程式为: _______________________________________________________。