镁-H2O2酸性燃料电池采用海水作电解质,下列结论错误的是
| A.电池总反应为:Mg+H2O2=Mg(OH)2 | B.正极发生的电极反应为:H2O2+2H++2e-=2H2O |
| C.工作时,正极周围海水的pH增大 | D.电池工作时,溶液中的H+ 向正极移动 |
依据下列条件能将某溶液的物质的量浓度计算出来的是()
①每10 mL溶液中含有0.23 g Na+的硫酸钠溶液
②每10个水分子中溶有1个Na+的NaOH溶液
③浓度为18.4 mol·L-1的硫酸10 mL加到100 mL水中所得的稀硫酸
④标准状况下,100 mL氨气溶于20 mL水中所得溶液的密度为0.9 g·cm-3的氨水
| A.①② | B.①③ |
| C.①④ | D.②③ |
在100 mL 0.10 mol·L-1的AgNO3溶液中加入100 mL溶有2.08 g BaCl2的溶液,再加入100 mL溶有0.010 mol CuSO4·5H2O的溶液,充分反应,下列说法中正确的是()
| A.最终得到白色沉淀和无色溶液 |
| B.最终得到的白色沉淀是等物质的量的两种化合物的混合物 |
| C.在最终得到的溶液中,Cl-的物质的量为0.02 mol |
| D.在最终得到的溶液中,Cu2+的物质的量浓度为0.01 mol·L-1 |
在t ℃时,向x g KNO3不饱和溶液中加入a g KNO3或蒸发掉b g水,恢复到t ℃,溶液均达到饱和,据此,下列推论不正确的是( )
A.在t ℃时,KNO3的溶解度为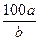 g g |
B.若原溶液中溶质的质量分数为 ,则x=2b ,则x=2b |
C.在t ℃时,所配的KNO3溶液中溶质的质量分数为w≤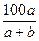 % % |
| D.若将原溶液蒸发掉2b g水,恢复到原温度析出2a g KNO3 |
相对分子质量为M的某物质,在室温下溶解度为S,此时测得饱和溶液的密度为ρ g·cm-3,则该饱和溶液的物质的量浓度是()
A. mol·L-1 mol·L-1 |
B. (100+S) mol·L-1 (100+S) mol·L-1 |
C.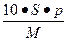 mol·L-1 mol·L-1 |
D.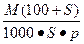 mol·L-1 mol·L-1 |
有物质的量浓度为10 mol·L-1,质量分数为32%的氨水,加入一定的水后,物质的量浓度变为5 mol·L-1,则质量分数为( )
| A.大于16% | B.等于16% | C.小于16% | D.无法确定 |