某温度下,在体积为5L的密闭容器中,充入1molA气体,发生如下可逆反应: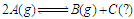 ,2min后反应达到平衡, A为0.4mol。当改变反应条件时符合如图的变化(P0表示1个大气压)。则下列叙述中不正确的是
,2min后反应达到平衡, A为0.4mol。当改变反应条件时符合如图的变化(P0表示1个大气压)。则下列叙述中不正确的是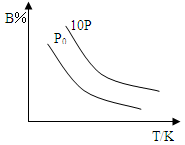
| A.0~2min时间内B物质的平均反应速率为0.03mol/(L·min) |
| B.该反应的正反应是放热反应,且C为非气体物质 |
| C.达到平衡后,保持温度和容器体积不变,再充入1 molA, 平衡向正反应方向移动 |
D.若温度和容器体积不变,起始时充入B和C各0.5mol ,则达到平衡时,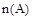 小于0.4mol 小于0.4mol |
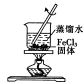
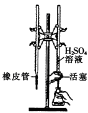
下列实验装置或操作设计正确且能达到实验目的的是
 |
 |
 |
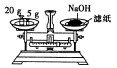 |
| A配制一定物质的量浓度的稀硫酸 |
B制取少量的Fe(OH)3胶体 |
C用H2SO4标准溶液滴定NaOH溶液 |
D称量NaOH固体 |
下表中对应关系正确的是
| A |
向某溶液中加入盐酸产生无色气体 |
溶液中一定含有CO32− |
| B |
由油脂得到甘油 由淀粉得到葡萄糖 |
均发生了水解反应 |
| C |
Cl2+2Br-=2Cl-+Br2 Zn+Cu2+=Zn2++Cu |
均为单质被还原的置换反应 |
| D |
2Na2O2+2H2O+4NaOH+O2↑ Cl2+H2O="HCl+HClO" |
均为水作还原剂的氧化还原反应 |
下列关于常见有机物的说法不正确的是
| A.CH2Cl2有两种同分异构体 |
| B.乙酸和油脂都能与氢氧化钠溶液反应 |
| C.可以用水来鉴别苯和CCl4 |
| D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别 |
下列说法正确的是()
| A.正反应为吸热反应的可逆反应达到平衡时,升高温度,V正增大,V逆减小。 |
| B.其它条件不变,压强越大活化分子百分数越大,反应速率越大。 |
| C.浓度越大反应速率越大,所以5 mol·L-1·s-1的反应速率一定比1 mol·L-1·s-1的大。 |
| D.其它条件不变,使用催化剂能降低活化能,虽不能改变反应热,但能加快反应速率。 |
已知1 mol胆矾溶于水时会使溶液温度降低,热效应为ΔH1;在室温下将1 mol无水硫酸铜制成溶液时会使溶液温度升高,热效应为ΔH2;而胆矾分解的热化学方程式是CuSO4·5H2O(s)=CuSO4(s)+5H2O(l) ΔH3,则下列判断正确的是()
| A.ΔH2>ΔH3 | B.ΔH1<ΔH3 | C.ΔH1+ΔH3==ΔH2 | D.ΔH1+ΔH2>ΔH3 |