“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。
下列有关该方法的叙述中错误的是
| A.能耗大是该方法的一大缺点 |
| B.整个过程中,有两种物质可以循环利用 |
| C.捕捉到的CO2可用来制备甲醇等产品,可减少碳排放 |
| D.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤 |
下列实验操作均要用到玻璃棒,其中玻璃棒的作用及其目的相同的是 
 ①过滤 ②蒸发 ③溶解④向容量瓶中转移液体
①过滤 ②蒸发 ③溶解④向容量瓶中转移液体
| A.①和④ | B.①和③ | C.①和② | D.③和④ |
在进行蒸馏操作中,加热一段时间后,发现碎瓷片忘加,应采取的正确操作是
| A.立即补加 | B.冷却后补加 | C.不需补加 | D.重新配料 |
下列物质中,不属于电解质的是
| A.H2SO4 | B.AgCl | C.NaOH | D.酒精 |
下列各选项所描述的两个量,前者一定大于后者的是
| A.纯水在25℃和80℃时的pH值 |
| B.25℃时,pH=3的盐酸和AlCl3溶液中,水电离的氢离子的浓度 |
| C.耐火材料CaO和MgO的熔点 |
| D.1L pH = 2的盐酸和醋酸溶液中,分别投入足量锌粒,放出H2的物质的量 |
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如图,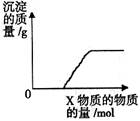
符合图中情况的一组物质是
| A |
B |
C |
D |
|
| X |
Ba(HCO3)2溶液 |
Na2CO3溶液 |
KOH溶液 |
CO2气体 |
| Y |
NaOH溶液 |
CaCl2溶液 |
Mg(HSO4)2溶液 |
石灰水 |