氯化铁是常见的水处 理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
(1)试写出吸收塔中反应的离子方程式: 。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH20) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是: 。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(4)FeCl3的质量分数通常可用碘量法测定:称取6克无水氯化铁样品,溶于稀盐酸,再转移到250mL容量瓶,用蒸馏水定容;取出25mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1 mol/L Na2S2O3溶液滴定用去V mL。
(已知:2Fe3+ +2I-= I2+2Fe2+ I2+2S2O32-=2I-+S4O62-)
①滴定终点的现象是: 。
②滴定至终点,实验数据如下表所示: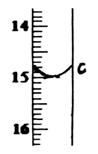
(第一次滴定终点的数据如右图中c点所示,请将你读得的数据填入表中)
| 滴定次数 |
待测液体积(mL) |
滴定前读数(mL) |
滴定后读数(mL) |
| 第一次 |
25.00 |
0.00 |
c= |
| 第二次 |
25.00 |
0.00 |
14.99 |
| 第三次 |
25.00 |
0.00 |
15.01 |
则样品中氯化铁的质量分数为 (写出最终的计算结果)。
③下列操作可能使测定结果偏低的是 。
A.滴定管在注入溶液前用蒸馏水洗后未用标准液润洗
B.开始时碱式滴定管尖嘴部分留有气泡,滴定过程中消失
C.盛FeCl3溶液的锥形瓶滴定前用FeCl3溶液润洗了2次
D.滴定前仰视滴定管读数,滴定后平视滴定管读数
.已知室温下乙醛的沸点为20.8℃,且与水互溶。用HgSO4做催化剂,在75℃左右,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种:现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制取乙醛,装置如下图所示,请回答下列问题;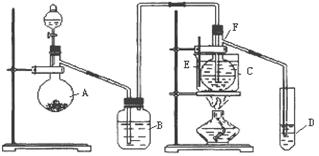
(1)实验开始时,仪器A中盛放电石,B中应装,其作用是。
(2)仪器D中盛放水,其作用是。
(3)蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各试剂的名称。将HgO加放到F中的操作方法是。
(4)装置图中,加热F的方法叫,所选用温度计F的量程表示正确的是
(填代号)。
| A.0℃~50℃ | B.0℃~100℃ | C.0℃~200℃ | D.0℃~360℃ |
(5)检验乙醛已制出的操作及现象是
。
下列操作或叙述不正确的是(填序号)。
| A.在催化剂存在的条件下,苯和溴水发生反应可生成无色、比水重的液体溴苯 |
| B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验 |
| C.乙醇中含有少量水可加入硫酸铜再蒸馏制得无水乙醇 |
| D.试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,然后加热制取乙酸乙酯 |
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动
F.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
G.苯酚不小心沾在手上,立即用NaOH溶液清洗
H.某些蛋白质与浓硝酸作用显黄色
(10分) 无水CuSO4在强热下会发生分解反应:
CuSO4 CuO + SO3↑
CuO + SO3↑
2SO3 2
2 SO2↑+ O2↑
SO2↑+ O2↑
某研究性学习小组设计了下图所示装置(夹持仪器已略去),利用D管在反应前后的质量差计算分解的无水CuSO4的质量。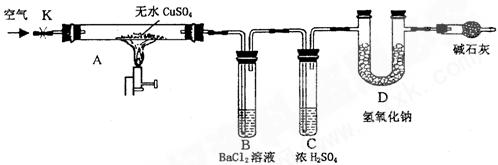
实验步骤:
①称量反应前D 管的质量。
管的质量。
②连接好装置,关闭K,加热硬质玻璃管A一定时间后,停止加热 。
。
③待硬质玻璃管A冷却后,打开K,通入一段时间的空气。
④再称量D管,得其反应前后的质量差为m。
(1)B管中出现的现象是__________________________________________________。
有关离子方程式是__________________________________________________
(2)B管的作用是除去混合气体中的SO3,实验过程中发现B管的温度明显升高,主要原因是______________________
(3)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算分解的无水CuSO4的质量?___________
原因是__________________________________________________________。
二氧化锰(MnO2)与浓盐酸混合加热可得到氯气,下图是制取并探究Cl2化学性质的装置图。
(1)圆底烧瓶中发生反应的化学方程式为。
(2)A 中m 管的作用是。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是。
(4)E中若装有FeCl2 溶液,反应的离子方程式为;E中若装有淀粉碘化钾溶液,能观察到的实验现象是。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,长郡中学高二化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体,加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2 中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是;
实验c的目的是。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是。
为比较Fe2+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题: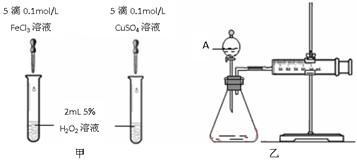
(1)定性分析:如图甲可通过观察定性比较得出结论,有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为,实验中需要测量的是。
(3)某同学要利用乙装置测定某H2O2溶液的物质的量浓度。在锥形瓶中加入0.10 mol MnO2粉末后加入50 mL 该H2O2溶液,在标准状况下放出气体的体积和时间的关系如图所示。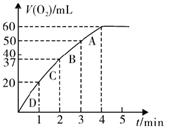
①写出H2O2在MnO2作用下发生反应的化学方程式;
②实验中放出气体的总体积是mL;
③A、B、C、D各点反应速率快慢的顺序为>>>;
④计算H2O2的初始的物质的量浓度。(结果保留2位小数)