(10分)A~G各物质间的关系如下图,其中B、D为气态单质。
请回答下列问题:
(1)物质C和E的名称分别为________________、__________________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_____________;
若只能在加热情况下进行,则反应物A应为_____________;
(3)反应②的化学方程式为_______________________________________;
(4)新配制的F溶液 应加入_____________以防止其转化为G。检验G溶液中阳离子的常用试剂是_____________,实验现象为______________________________________。
应加入_____________以防止其转化为G。检验G溶液中阳离子的常用试剂是_____________,实验现象为______________________________________。
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
(1)甲同学设计实验的依据是____________________________________;
写出选用物质的名称:A____________,B__________,C____________;
上述反应的离子方程式分别为________________________________;
____________________________________________________________。
(2)乙同学的实验原理是__________________________________。
写出B处的离子方程式: _______________________________________。
在下图所示的物质转化关系中。A是常见气态氢化物,B是能使带火星的木条复燃的无色无味气体,E的相对分子质量比D大17,G是一种紫红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)
请回答下列问题:
(1)B的化学式为。
(2)A的电子式为。
(3)反应①的化学方程式为 。
(4)反应②的离子方程 式为 。
海洋约占地球表面积的71%,海水中化学资源的利用具有非常广阔的前景。
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下: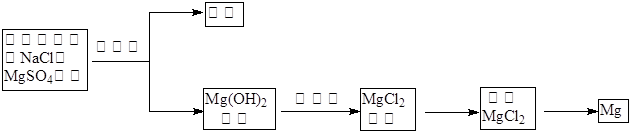 试剂①宜选用石灰乳且必须过量,过量的目的是.
试剂①宜选用石灰乳且必须过量,过量的目的是.
② 镁蒸气宜在(填序号)气体冷却后得到镁锭
| A.N2 | B.CO2 | C.Ar | D.空气)(2)工业以浓缩海水为原料提取溴的部分过程如下: |
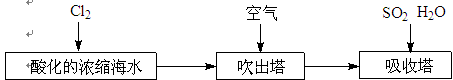
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
③A装置中通入a气体时,反应的离子方程式表示为:.
④A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是:
.
⑤反应过程中,B装置中产生的两种主要阴离子为.
⑥C装置的作用是。
如下图所示装置,请回答下列问题: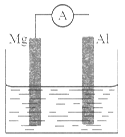
(1)若烧杯中溶液为稀硫酸,则观察到的现象为__________________。
两极反应式为:正极_______________________________;
负极_______________________________。
该装置将_________能转化为_________能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________,电子流向:__ _______________总反应方程为____________________________。
常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:
(1)写出MOH在水溶液中的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)_______;此时,混合溶液中由水电离出的c(H+)___ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)写出B点混合溶液中各离子浓度的大小关系__________;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L(数字表达式,不必具体算出结果)