如下图所示装置,请回答下列问题: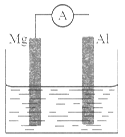
(1)若烧杯中溶液为稀硫酸,则观察到的现象为__________________。
两极反应式为:正极_______________________________;
负极_______________________________。
该装置将_________能转化为_________能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________,电子流向:__ _______________总反应方程为____________________________。
某烃类化合物A的质谱图表明其相 对分子质量为84,红外光谱表明分子
对分子质量为84,红外光谱表明分子 中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为;
(2)A中的碳原子是否都处于同一平面?(填“是”或者“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。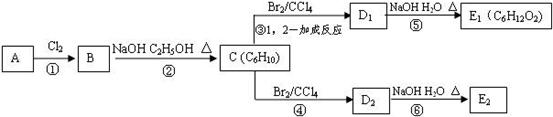
反应②的化学方程式为;C的化学名称为;E2的结构简式是;④、⑥的反应类型依次是
 。
。
汽油不仅是重要的燃料,而且是重要的化工原料,可以通过汽油裂解得到化工原料如乙烯等,还可以在催化剂作用下改变汽油分子的结构,由链烃变为芳香烃,这种变化叫做异构化。下面是以石油为原料发生的有机物的衍变关系图: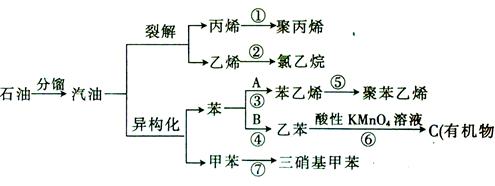
(已知:反应③,④中的原子利用率均为100%)
请回答下列问题:
(1)上述反应①~⑦中属于加成反应的有___________________(填序号,下
同),属于取代反应的有__________________。
(2)写出A,B的结构简式:A______________,B________________。
C的分子式为_________________。
(3)写出下列反应的化学方程式:
④________________________________________________________________;
⑦____________________ ____________________________________________。
____________________________________________。
某有机化合物结构如下,分析其结构并完成下列问题: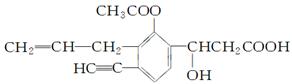
(1)写出其分子式__________。
(2)写出含氧官能团的名称________________________________。
(3)其中含有__ ___个不饱和碳原子,分子中有_______
___个不饱和碳原子,分子中有_______ _种双键,有___
_种双键,有___ _________个手性碳原子。
_________个手性碳原子。
(4)一定与苯环处于同一平面的碳原子有________个,分子中C≡C—H键角为________。
按要求填空:
①写出含有乙基的C7H16的结构简式________________________________。
②写出分子式为C9H12,苯环上的一氯代物、二氯代物分别有3种,没有四氯代物的结构简式__________________________。
目前世界上比较先进的电解制碱技术是离子交换法,如图为 阳离子交换膜法电解饱和食盐水的原理示意图。
阳离子交换膜法电解饱和食盐水的原理示意图。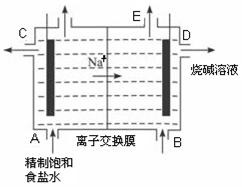
(1)下列说法不正确的是()
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D .粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液
.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液
(2)现有离子交换膜A和B将电解槽分为I、II、III三个区域(下图所示),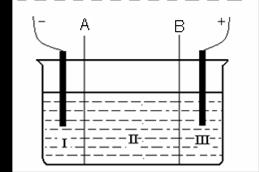
在这 种电解池中电解Na2SO4溶液可制得氢氧化钠、硫酸等物质。
种电解池中电解Na2SO4溶液可制得氢氧化钠、硫酸等物质。
A为离子交换膜、B为离子交换膜(填“阴”或“阳”),电极均为惰性电极。Na2SO4溶液应该在区(填“I”、“II”、“III”)加入。通电电解时阴极的电极反应式为,在III区得到。当外电路总共通过30 mol电子时,生成的NaOH 960克,则电解过程中能量的转化率为: