下列离子方程式正确的是
| A.NaHCO3溶液中加入少量的石灰水:HCO3—+Ca2++OH—=CaCO3↓+H2O |
| B.FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br—+2Cl2=2Fe3++4Cl—+Br2 |
| C.Fe3O4与稀硝酸反应:2Fe3O4+18H+=6Fe3++H2↑+8H2O |
| D.氨水中通入过量SO2:2NH3·H2O+SO2=SO32—+2NH4++H2O |
下列比较中,正确的是
| A.同温和同物质的量浓度时,HF比HCN易电离,则溶液pH:NaF>NaCN |
| B.物质的量浓度相等的H2S和NaHS混合溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| C.0.1mol/L的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小 |
| D.体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等量的锌粉,前者用时长 |
下列离子方程式与所述事实相符且正确的是
| A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B.用FeCl3溶液腐蚀铜板制印刷电路板:Fe3++2Cu=Fe2++2Cu2+ |
| C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ |
| D.碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如下图所示: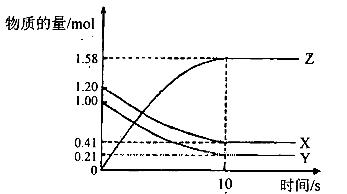
下列描述正确的是
| A.反应开始到10s,用Z表示的反应速率为0.158 mol/(L·s)-1 |
| B.反应开始到l0s,X的物质的量浓度减少了0.79 mol/L |
| C.反应开始到10S时,Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
下列有关结论中,正确的是
| A.浓度为0.lmol/LCuSO4溶液,温度升高,溶液的pH降低 |
| B.—元酸与—元碱恰好完全反应后的溶液中—定存在c(H+)=c(OH-) |
C.浓度相同的AlCl3、NH3 H2O、Ba(OH2)三物质的溶液,等体积混合时没有沉淀生成 H2O、Ba(OH2)三物质的溶液,等体积混合时没有沉淀生成 |
| D.在所有能够溶解Al(OH)3的溶液中Cu2+、ClO-、Cl-、 Ca2+一定能够大量共存 |
海洋中资源丰富,以海水为原料可制得一系列产品,如下图所示: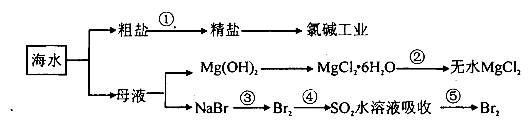
下列有关说法正确的是
| A.第①步除去粗盐SO42-、Ca2+、Mg2+、Fe3+等杂质离子,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
B.将第②步结晶出的MgCl2 6H2O在空气中加热分解制备无水MgCl2 6H2O在空气中加热分解制备无水MgCl2 |
| C.在第③④⑤步中溴元素均被氧化 |
| D.电解饱和食盐水时,在阴极区生成NaOH |