一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如下图所示: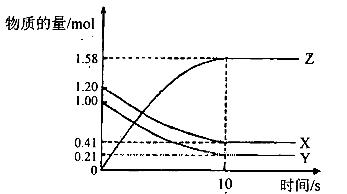
下列描述正确的是
| A.反应开始到10s,用Z表示的反应速率为0.158 mol/(L·s)-1 |
| B.反应开始到l0s,X的物质的量浓度减少了0.79 mol/L |
| C.反应开始到10S时,Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
某氯碱厂不慎有大量氯气逸出周围空间,此时,可以用浸有某种物质的一定浓度的水溶液的毛巾捂住鼻子。最适宜采用的物质是( )
| A.NaOH | B.NaCl | C.KBr | D.Na2CO3 |
关于电解NaCl水溶液,下列叙述正确的是( )
| A.电解时在阳极得到氯气,在阴极得到金属钠 |
| B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色 |
| C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色 |
| D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性 |
石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑。以下解决能源问题的方法不当的是( )
| A.用木材作燃料 |
| B.用液氢替代汽油 |
| C.开发风能 |
| D.开发地热 |
下列关于硬水的叙述错误的是( )
| A.硬水中的Ca2+、Mg2+会阻碍肥皂起泡 |
| B.用漂白粉对自来水消毒,会增加水的总硬度 |
| C.向硬水中加入明矾,可以使硬水软化 |
| D.雨水的硬度比海水的硬度小 |
用惰性电极电解500mLNaCl溶液,当两极产生的气体总体积为16.8mL(标准状况)时,溶液的pH范围为( )
| A.8~10 | B.10~12 | C.5~6 | D.3~4 |