主族元素的阳离子和阴离子都具有稀有气体元素原子的结构特征,阳离子比阴离子少两个电子层的离子化合物是
| A.MgCl2 | B.NaBr | C.HCl | D.NaI |
下列离子方程式书写正确的是:
| A.过量的SO2通入NaOH溶液中:SO2+2OH-=SO32-+H2O |
| B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
| C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O |
| D.NaHCO3溶液中加入过量的Ba(OH)2溶液2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- |
右图是一种染料敏化太阳能电池的示意图,电池的一个电极由有机光敏染料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为: 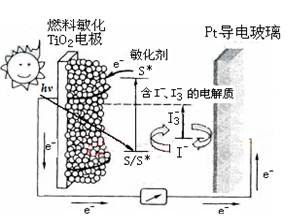
TiO2/S→TiO2/S*(激发态)
TiO2/S*→TiO2/S++e-
I3-+2e-→3I-
2TiO2/S++3I-→2TiO2/S+I3-
下列关于该电池叙述错误的是:
| A.电池工作时,I-离子在镀铂导电玻璃电极上放电 |
| B.电池工作时,是将太阳能转化为电能 |
| C.电池的电解质溶液中I-和I3-的浓度不会减少 |
| D.电池中镀铂导电玻璃为正极 |
下列叙述正确的是:
| A.Li在氧气中燃烧主要生成Li2O2 |
| B.将CO2通入溶有漂粉精的水溶液中可生成次氯酸 |
| C.将SO2通入CaCl2溶液可生成CaSO3沉淀 |
| D.将NH3通入热的CuSO4溶液中可使Cu2+还原成Cu |
下列家庭实验中不涉及化学变化的是:
| A.用熟苹果催熟青香蕉 | B.用少量食醋除去水壶中的水垢 |
| C.用糯米、酒曲和水制甜酒酿 | D.用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐 |
如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态(提示:物质X、Y的状态均未知,物质Z的状态为气态):2X(?)+ Y(?)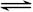 a Z(g)
a Z(g)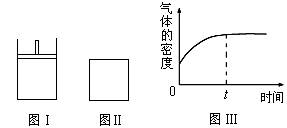
此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是
| A.物质Z的化学计量数a = 2 |
| B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态 |
| C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ |
| D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |