雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
⑴As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,该反应的化学方程式为 。
⑵上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
⑶As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 极附近逸出。
⑷将⑶中反应产物NO2充满干燥的烧瓶,然后将烧瓶倒立于少水槽中,向烧瓶中通入一定量的氧气,气体恰好完全溶于水(假设溶液没有扩散),则烧瓶中溶液溶质的物质的量浓度为 (设该条件下的气体摩尔体积为23.8 ,结果保留到小数点后三位)。
,结果保留到小数点后三位)。
利用化合价推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①SO2的性质________________(填序号,下同)
A.只有氧化性B.只有还原性C.既有还原性又有氧化性
②SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应后,锰元素被还原成Mn2+,写出上述反应的离子方程式_________________________________
(2)Fe(OH)2很不稳定,露置在空气中容易被氧化,发生反应的离子方程式为__________________________________________________为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配置的NaOH溶液反应制备。
①用硫酸亚铁晶体配置上述硫酸亚铁溶液时,还需加入_________来防止Fe2+被氧化
②除去蒸馏水中溶解的O2常采用_______的方法
(3)检验Fe3+的方法:_______________________(写出加入试剂的化学式和现象与结论)
按要求写下列化学方程式(1)、(4)或离子方程式(2)(3)
(1)实验室用Ca(OH)2和NH4Cl制取氨气_______________________________
(2)过氧化钠粉末投入水中_____________________________________________
(3)向氯化铝溶液中加入足量氨水_______________________________________
(4)漂白粉在空气中变质_______________________________________________
实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:
请回答下列问题:
(1)实验室只有100 mL、250 mL、500 mL三种规格的容量瓶,但要配制480 mL 0.50 mol/L的稀硫酸,需取该浓硫酸mL。
(2)接下来完成此实验你将用到的仪器有20 mL量筒、烧杯、玻璃棒、____________。
(3)要从所配溶液中取出50 mL盛装于试剂瓶中,给它贴上标签,则标签的内容是________________;若再从中取出10 mL溶液稀释至20 mL,则稀释后溶液的物质的量浓度为__________。
(4)下列操作会使所配溶液浓度偏低的是。
| A.用量筒量取浓硫酸,读数时仰视刻度线 |
| B.转移溶液时未洗涤烧杯 |
| C.容量瓶用蒸馏水洗净后仍残留有蒸馏水 |
| D.定容时俯视容量瓶的刻度线 |
E.定容摇匀后,发现液面低于刻度线,再加水至刻度线
A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去)。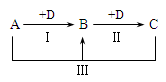
(1)若A为强碱溶液,其焰色反应显黄色,C为厨房中用品,请回答下列问题:
①D的化学式是。
②反应III的离子方程式是。
③现有B和C的固体混合物a g,加热至质量不再改变时剩余固体 b g,则B的质量分数为_______________。
(2)若A、D均为单质,且A为黄绿色气体,D的一种红棕色氧化物常用作颜料,则:
①反应III的离子方程式是。
②取少许C溶液于试管中,滴入NaOH溶液并振荡,发生反应的化学方程式为:______________________________,________________________________。
③检验C溶液中金属阳离子的操作是。
镁与稀硝酸的反应为:Mg+ HNO3(稀)—— Mg(NO3)2+ NH4NO3+ H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目。
(2)该反应中,还原产物是_________,HNO3表现了________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。
(3)若反应过程中转移的电子数为6.02×1023,则被还原的硝酸物质的量为________。