利用化合价推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①SO2的性质________________(填序号,下同)
A.只有氧化性 B.只有还原性 C.既有还原性又有氧化性
②SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应后,锰元素被还原成Mn2+,写出上述反应的离子方程式_________________________________
(2)Fe(OH)2很不稳定,露置在空气中容易被氧化,发生反应的离子方程式为__________________________________________________为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配置的NaOH溶液反应制备。
①用硫酸亚铁晶体配置上述硫酸亚铁溶液时,还需加入_________来防止Fe2+被氧化
②除去蒸馏水中溶解的O2常采用_______的方法
(3)检验Fe3+的方法:_______________________(写出加入试剂的化学式和现象与结论)
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 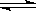 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)达平衡的时间是,理由是。
(2)右图中表示NO2的变化的曲线是。用O2表示从0~2 s内该反应的平均速率v=。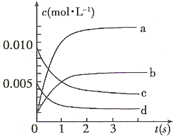
(3)能说明该反应已达到平衡状态的是。
a.v(NO2) = 2v(O2) b.容器内各物质的浓度保持不变
c.v逆(NO) = 2v正(O2)d.达到化学平衡时,NO将完全转化为NO2
(4)能增大该反应的反应速率是。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(11分)物质结构和元素周期律是化学的重要理论知识,通过学习这部分知识,可以对所学元素化合物等知识从理论角度进一步加深理解。有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在点燃条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述完成下列问题:
(1)元素名称:A_________, B__________, C__________, D_________。
(2)写出B元素在周期表中的位置,第______周期,第________族。
(3)A与B可形成多种化合物,其中会引起温室效应的这一者的电子式为____________
(4)C单质在点燃条件下与B单质充分反应所得固体的化学为______________,该固体化合物类型为_______________,存在的作用力有________________。
(5) 用电子式表示化合物C2D的形成过程_____________________________________。
已知:(X代表卤素原子,R代表烃基)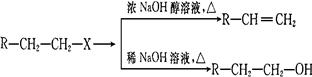
利用上述信息,按以下步骤从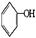 合成
合成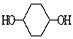 。(部分试剂和反应条件已略去)
。(部分试剂和反应条件已略去)
请回答下列问题:
(1)分别写出B、D的结构简式:B_________、D_________。
(2)反应①~⑦中属于消去反应的是_________。(填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为:___
(4)试写出C D反应的化学方程式(有机物写结构简式,并注明反应条件)
D反应的化学方程式(有机物写结构简式,并注明反应条件)
在有机物:①CH3CH3、②CH2=CH2、③CH3CH2C≡CH、④CH3C≡CCH3、⑤C2H6、⑥CH3CH=CH2中,一定互为同系物的是,一定互为同分异构体的是。(填编号)
(11分)根据下面的反应路线及所给信息填空。
(1)A的结构简式是__________,名称是__________。
(2)①的反应类型是__________;②的反应类型是__________。
(3)反应④的化学方程式是________________________________________